1 引 言
2 材料与方法
2.1 化学品和材料
2.2 电镜表征
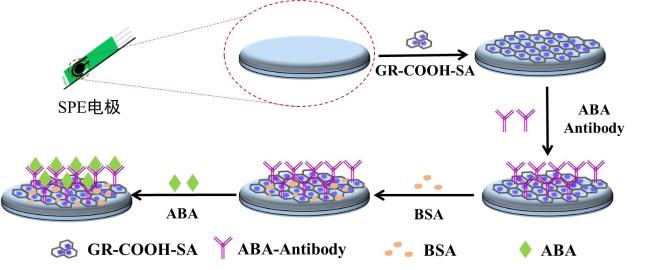
2.3 ABA免疫传感器制作方法
2.4 电化学测量
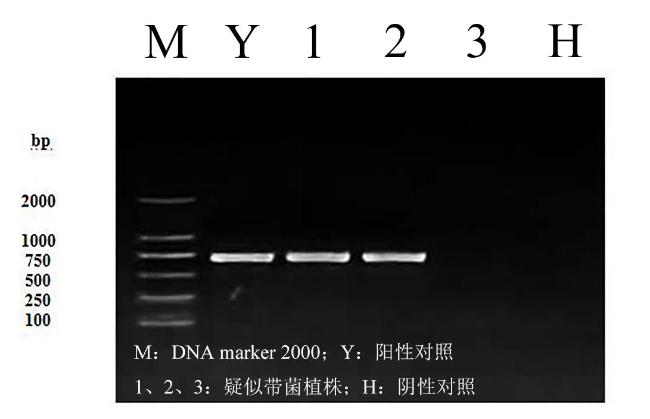
2.5 柑橘培养及样品制备
表1 检测脐橙叶片是否感染黄龙病实验PCR反应程序条件Table 1 Polymerase chain reaction reaction procedure and conditions for detecting whether navel orange leaves are infected with Huanglongbing |
| 预变性 | 变性 | 退火 | 延伸 | 延伸 | 保存 |
|---|---|---|---|---|---|
| (35 循环) | |||||
| 95 ℃ | 95 ℃ | 58.5 ℃ | 72 ℃ | 72 ℃ | 4 ℃ |
| 3 min | 30 s | 30 s | 30 s | 10 min | ∞ |
|
2.6 脐橙总RNA提取与cDNA合成
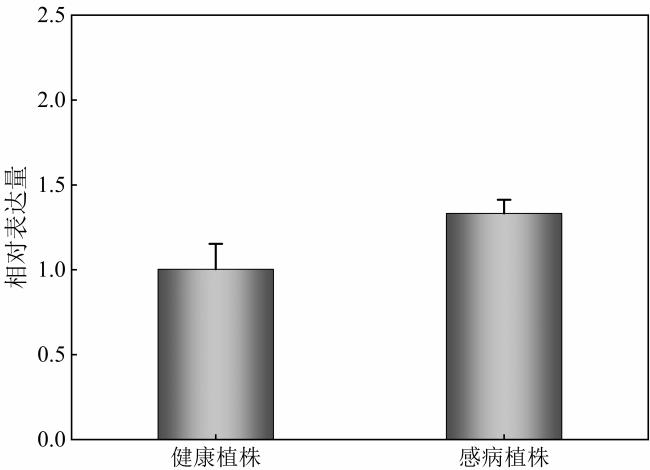
2.7 实时荧光定量PCR
表2 脐橙叶片中ABA相关基因表达量分析试验荧光定量PCR引物序列Table 2 Fluorescence quantitative polymerase chain reaction primer sequence of abscisic acid-related gene expression analysis experiment in navel orange leaves |
| 基因名称 | 引物序列 | 退火温度/℃ | |
|---|---|---|---|
| CitZEP | 上游引物 | 5'-TTTTTCTCGAACATCGATTGTGA-3' | 58 |
| 下游引物 | 5'-GTAGAAGGCACCATCTTTATAGCTGAT-3' | ||
| Actin | 上游引物 | 5'-CCAAGCAGCATGAAGATCAA-3' | 60 |
| 下游引物 | 5'-ATCTGCTGGAAGGTGCTGAG-3' |
3 试验结果与讨论
3.1 修饰过程的形貌分析
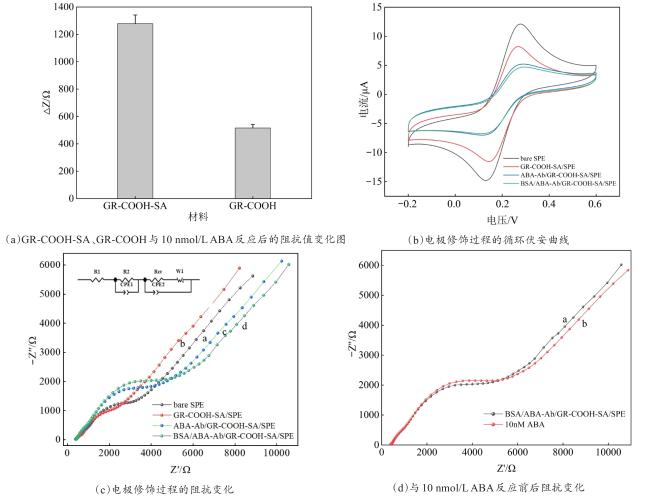
3.2 传感器检测ABA的可行性分析
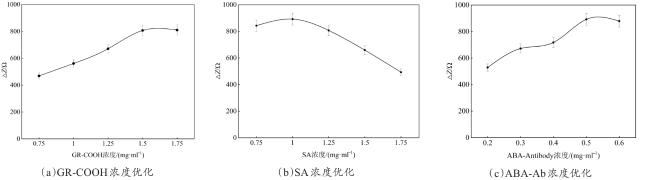
3.3 制备优化
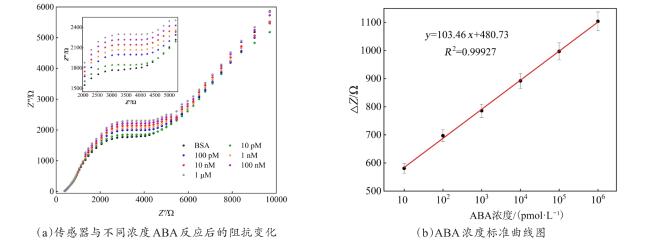
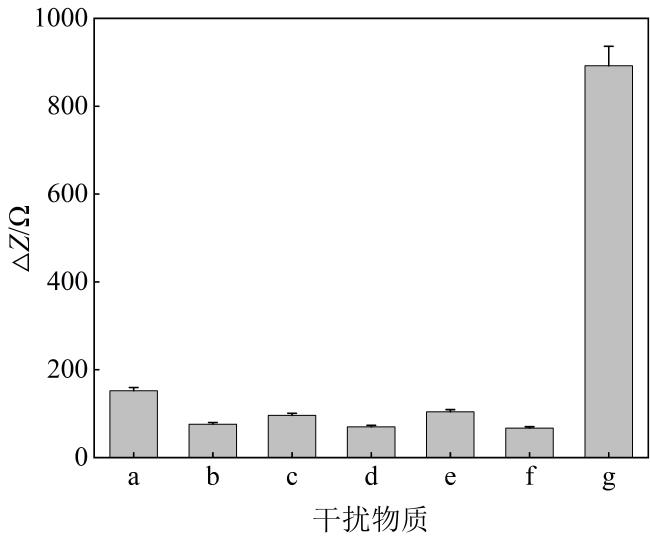
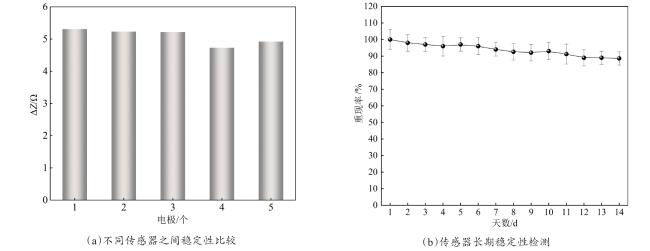
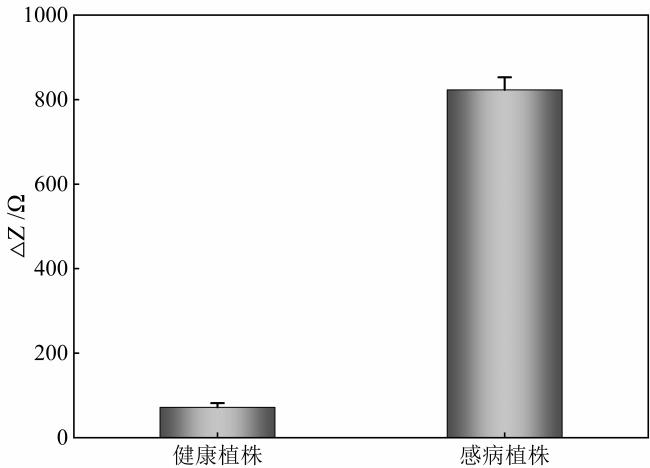
3.4 检测性能测试
表3 不同方法检测ABA的性能对比Table 3 Comparison of the performance of different methods for the detection of abscisic acid |