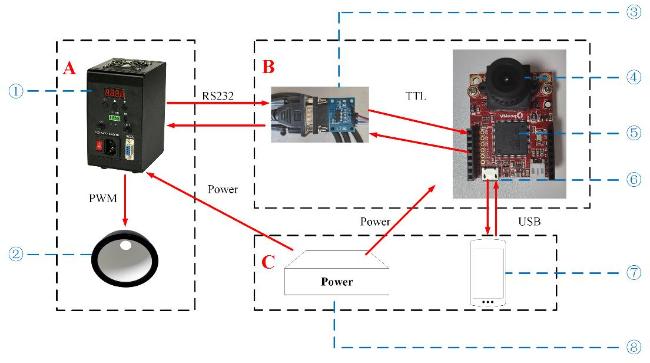
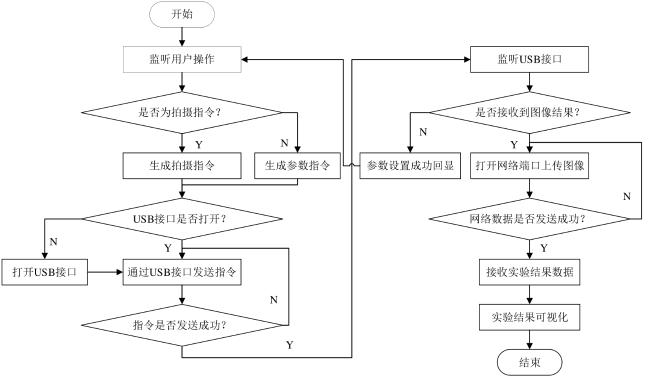
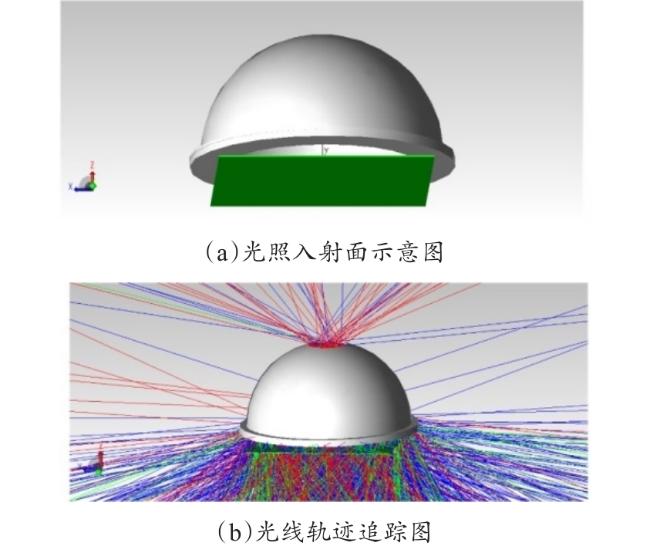
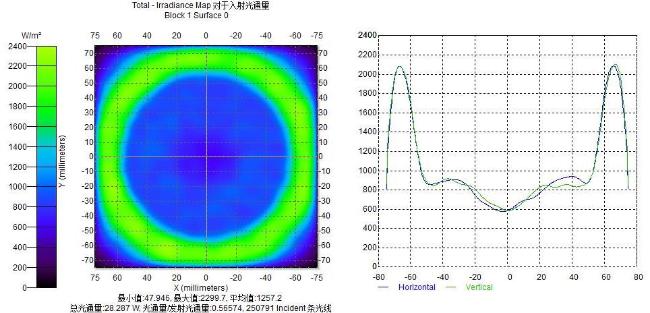
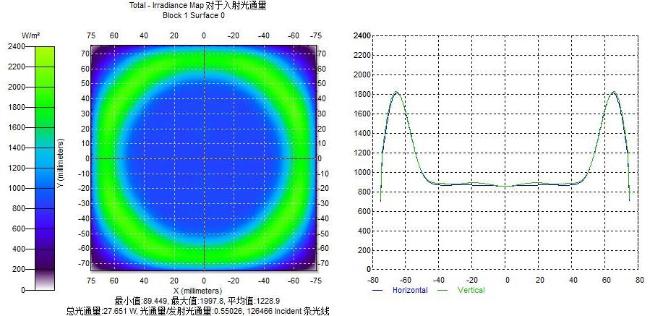
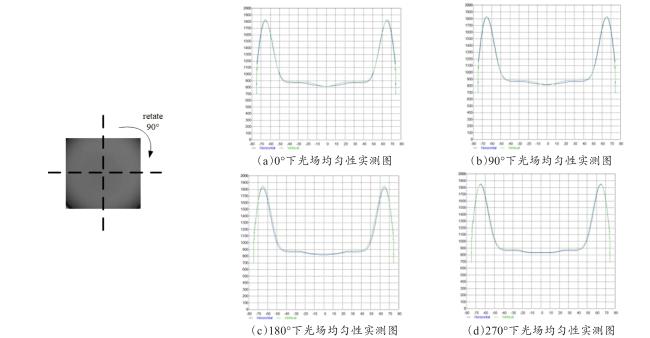
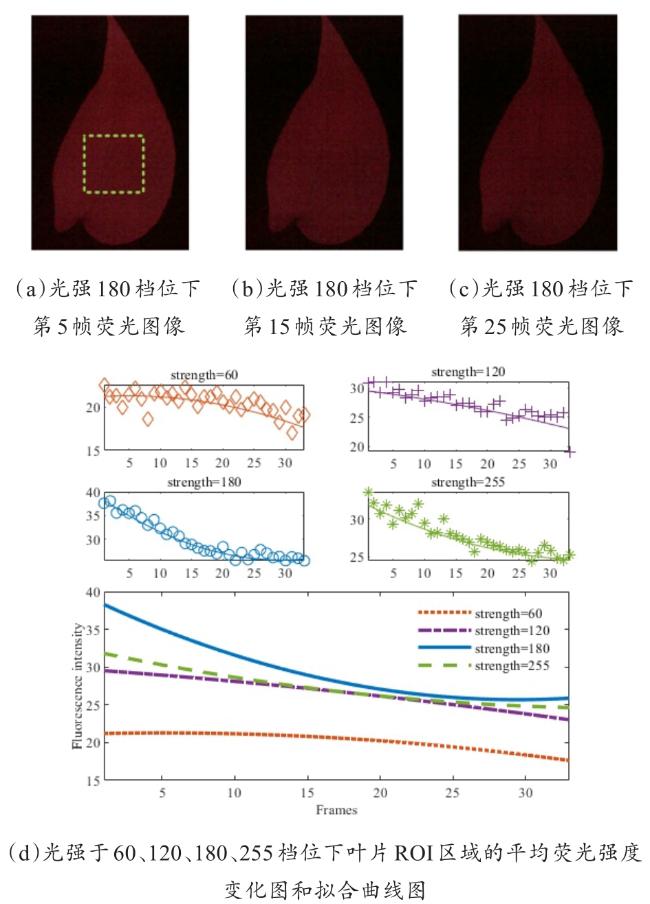
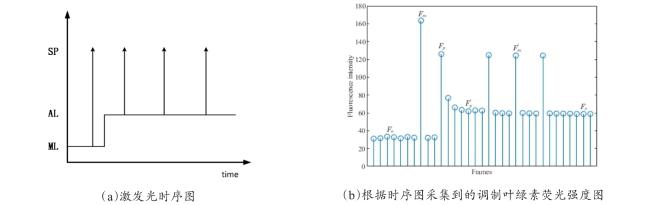
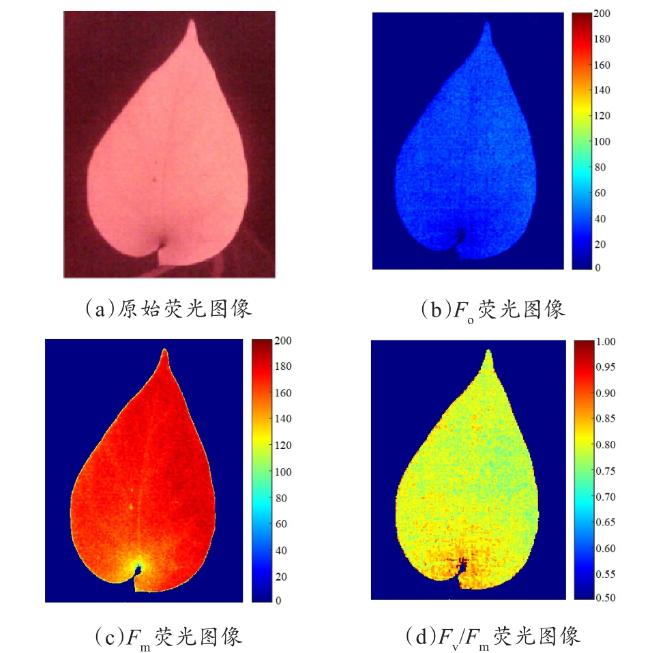
[Objective] Chlorophyll fluorescence (ChlF) emission from photosystem II (PSII) is closely coupled with photochemical reactions. As an efficient and non-destructive means of obtaining plant photosynthesis efficiency and physiological state information, the collection of fluorescence signals is often used in many fields such as plant physiological research, smart agricultural information sensing, etc. Chlorophyll fluorescence imaging systems, which is the experimental device for collecting the fluorescence signal, have difficulties in application due to their high price and complex structure. In order to solve the issues, this paper investigates and constructs a low-cost chlorophyll fluorescence imaging system based on a micro complementary metal oxide semiconductor (CMOS) camera and a smartphone, and carries out experimental verifications and applications on it. [Method] The chlorophyll fluorescence imaging system is mainly composed of three parts: excitation light, CMOS camera and its control circuit, and a upper computer based on a smartphone. The light source of the excitation light group is based on the principle and characteristics of chlorophyll fluorescence, and uses a blue light source of 460 nm band to achieve the best fluorescence excitation effect. In terms of structure, the principle of integrating sphere was borrowed, the bowl-shaped light source structure was adopted, and the design of the LED surface light source was used to meet the requirements of chlorophyll fluorescence signal measurement for the uniformity of the excitation light field. For the adjustment of light source intensity, the control scheme of pulse width modulation was adopted, which could realize sequential control of different intensities of excitation light. Through the simulation analysis of the light field, the light intensity and distribution characteristics of the light field were stuidied, and the calibration of the excitation light group was completed according to the simulation results. The OV5640 micro CMOS camera was used to collect fluorescence images. Combined with the imaging principle of the CMOS camera, the fluorescence imaging intensity of the CMOS camera was calculated, and its ability to collect chlorophyll fluorescence was analyzed and discussed. The control circuit of the CMOS camera uses an STM32 microcontroller as the microcontroller unit, and completes the data communication between the synchronous light group control circuit and the smartphone through the RS232 to TTL serial communication module and the full-speed universal serial bus, respectively. The smartphone upper computer software is the operating software of the chlorophyll fluorescence imaging system user terminal and the overall control program for fluorescence image acquisition. The overall workflow could be summarized as the user sets the relevant excitation light parameters and camera shooting instructions in the upper computer as needed, sends the instructions to the control circuit through the universal serial bus and serial port, and completes the control of excitation light and CMOS camera image acquisition. After the chlorophyll fluorescence image collection was completed, the data would be sent back to the smart phone or server for analysis, processing, storage, and display. In order to verify the design of the proposed scheme, a prototype of the chlorophyll fluorescence imaging system based on this scheme was made for experimental verification. Firstly, the uniformity of the light field was measured on the excitation light to test the actual performance of the excitation light designed in this article. On this basis, a chlorophyll fluorescence imaging experiment under continuous light excitation and modulated pulse light protocols was completed. Through the analysis and processing of the experimental results and comparison with mainstream chlorophyll fluorometers, the fluorescence imaging capabilities and low-cost advantages of this chlorophyll fluorometer were further verified. [Results and Discussions] The maximum excitation light intensity of the chlorophyll fluorescence imaging system designed in this article was 6250 µmol/(m2·s). Through the simulation analysis of the light field and the calculation and analysis of the fluorescence imaging intensity of the CMOS camera, the feasibility of collecting chlorophyll fluorescence images by the OV5640 micro CMOS camera was demonstrated, which provided a basis for the specific design and implementation of the fluorometer. In terms of hardware circuits, it made full use of the software and hardware advantages of smartphones, and only consisted of the control circuits of the excitation light and CMOS camera and the corresponding communication modules to complete the fluorescence image collection work, simplifying the circuit structure and reducing hardware costs to the greatest extent. The final fluorescence instrument achieved a collection resolution of 5 million pixels, a spectral range of 400~1000 nm, and a stable acquisition frequency of up to 42 f/s. Experimental results showed that the measured data was consistent with theoretical analysis and simulation, which could meet the requirements of fluorescence detection. The instrument was capable of collecting images of chlorophyll fluorescence under continuous light excitation or the protocol of modulated pulsed light. The acquired chlorophyll fluorescence images could reflect the two-dimensional heterogeneity of leaves and could effectively distinguish the photosynthetic characteristics of different leaves. Typical chlorophyll fluorescence parameter images of Fv/Fm, Rfd, etc. were in line with expectations. Compared with the existing chlorophyll fluorescence imaging system, the chlorophyll fluorescence imaging system designed in this article has obvious cost advantages while realizing the rapid detection function of chlorophyll fluorescence. [Conclusions] The instrument is with a simple structure and low cost, and has good application value for the detection of plant physiology and environmental changes. The system is useful for developing other fluorescence instruments.