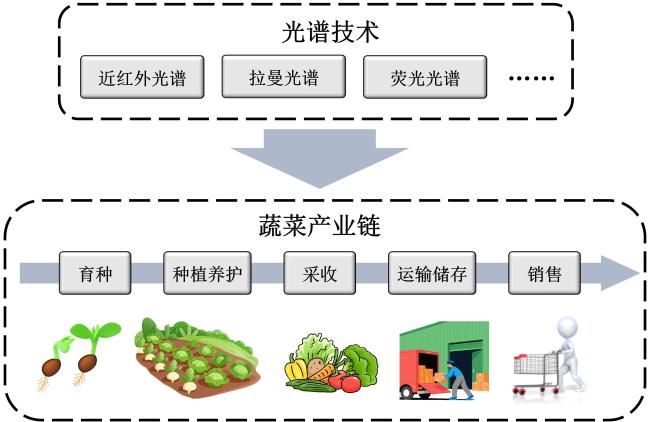
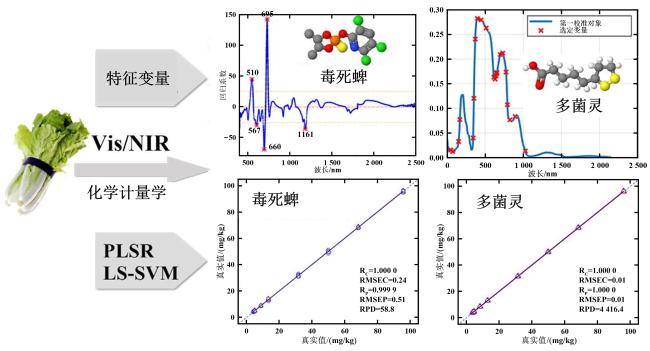
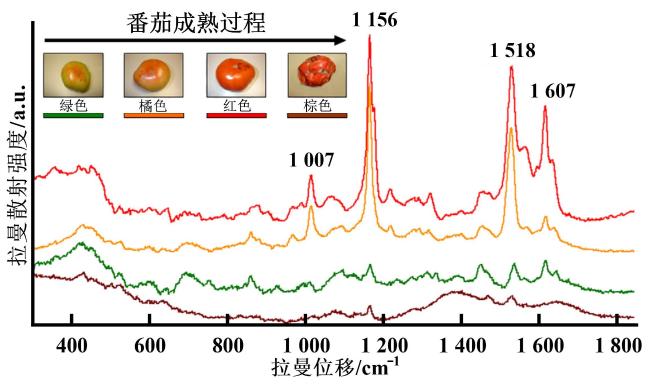
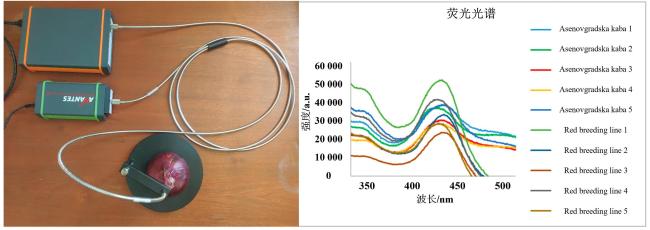
[Significance] Vegetables are indispensable to global food security and human nutrition, yet approximately 33% of the annual 1.2 billion-ton harvest is lost or wasted, largely because of undetected biotic and abiotic stresses, poor post-harvest management, and chemical safety hazards. Conventional analytical workflows, based on wet chemistry and chromatography, are destructive, labour-intensive, and difficult to scale, creating an urgent need for rapid, non-invasive sensing tools that can operate across the full production-to-consumption continuum. Optical spectroscopy, spanning near-infrared (NIR), Raman, fluorescence, laser-induced breakdown spectroscopy (LIBS), and UV-Vis modalities, offers label-free, multiplexed, and second-scale measurements directly on living plants or minimally processed products. Existing reviews have concentrated on isolated techniques or single application niches, leaving critical knowledge gaps regarding hardware robustness under open-field conditions, algorithmic generalisability across cultivars and climates, data interoperability, and cost-driven adoption barriers for smallholders. [Progress] This paper presents a holistic, chain-wide appraisal of spectroscopic sensing in vegetable production. It shows that hardware evolution has been dominated by miniaturisation and functional integration. Hand-held NIR units (e.g., Neospectra MEMS, NirVana AG410) now weigh <300 g and achieve R2 > 0.95 for soluble solids and moisture in tomato, zucchini, and pepper. Palm-top Raman systems (9 × 7 × 4 cm) equipped with 1 064 nm lasers and InGaAs detectors suppress fluorescence sufficiently to quantify lycopene (RMSE = 1.14 mg/100 g) and classify ripeness stages with 100% accuracy. Battery-powered fluorescence sensors coupled with smartphones wirelessly stream data to cloud-based convolutional neural networks (CNNs), delivering 93%~100% correct cultivar identification for spinach, onion, and tomato seeds within 5 s per sample. Methodological advances combine advanced chemometrics and deep learning. Transfer learning enables a model trained on greenhouse tomatoes to predict field-grown cherry tomatoes with only 10% recalibration samples, cutting data acquisition costs by 70%. SERS substrates, fabricated as flexible "place-and-play" nano-mesh films, boost Raman signals by 106~108, pushing limits of detection for carbaryl, imidacloprid, and thiamethoxam below 1 mg/kg on pak-choi and lettuce. Multi-modal fusion (LIBS-NIR) simultaneously quantifies macro-elements (Ca, K, Mg) and micro-elements (Fe, Mn) with relative errors <5%. Chain-wide demonstrations span five critical stages: (i) breeding—NIR screens seed viability via starch and moisture signatures; (ii) cultivation—portable Raman "leaf-clip" sensors detect nitrate deficiency (1 045 cm-1 peak) and early pathogen attack (LsoA vs. LsoB, 80% accuracy) in lettuce and tomato before visible symptoms emerge; (iii) harvest—non-invasive lycopene monitoring in tomato and carotenoid profiling in chilli guides optimal picking time and reduces post-harvest losses by 15%; (iv) storage—chlorophyll fluorescence tracks water loss and senescence in black radish and carrot over six-month cold storage, enabling dynamic shelf-life prediction; (v) market entry—LIBS inspects incoming crates for Pb and Cd in seconds, while fluorescence-SVM pipelines simultaneously verify pesticide residues, ensuring compliance with EU and Chinese MRLs. Data governance initiatives are emerging but remain fragmented. Several consortia have released open spectral libraries (e.g., VegSpec-1.0 with 50 000 annotated spectra from 30 vegetable species), yet differences in acquisition parameters, preprocessing pipelines, and metadata schemas hinder cross-study reuse. [Conclusions and Prospects] Spectroscopic sensing has matured from laboratory proof-of-concept to robust field prototypes capable of guiding real-time decisions across the entire vegetable value chain. Nevertheless, four priority areas must be addressed to unlock global adoption: Model generalisation—curate large-scale, multi-environment, multi-cultivar spectral repositories and embed meta-learning algorithms that continuously adapt to new genotypes and climates with minimal retraining. Hardware resilience—develop self-calibrating sensors with adaptive optics and real-time environmental compensation (temperature, humidity, ambient light) to maintain laboratory-grade SNR in dusty, humid, or high-irradiance field settings. Standardisation and interoperability—establish ISO-grade protocols for hardware interfaces, data formats, calibration transfer, and privacy-preserving data sharing, enabling seamless integration of devices, clouds, and decision-support platforms. Cost-effective commercialisation—pursue modular, open-hardware designs leveraging printed optics and economies of scale to reduce unit costs below USD 500, and introduce service-based models (leasing, pay-per-scan) tailored to smallholder economics. If these challenges are met, spectroscopy-based digital twins of vegetable production systems could become a reality, delivering safer food, reduced waste, and climate-smart agriculture within the next decade.