0 引 言
1 材料与方法
1.1 数据采集与处理
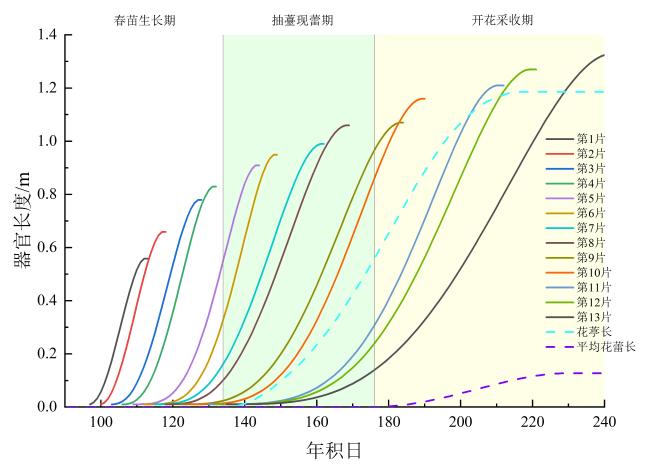
1.1.1 黄花生长形态指标及开花进程测定
表1 黄花各器官形态指标统计Table 1 Statistical analysis of morphological indicators for various organs in daylily |
| 形态指标(生长最终值) | 最大值 | 最小值 | 极差 | 平均值 | 标准差 |
|---|---|---|---|---|---|
| 叶片长度(1~13叶位)/cm | 70.30、84.10、98.20、102.40、109.80、112.70、120.80、122.20、124.10、130.90、132.30、134.20、136.40 | 45.80、54.20、66.30、71.70、77.90、80.20、81.80、88.00、92.20、94.50、99.30、101.40、102.90 | 24.50、29.90、31.90、30.70、31.90、32.50、39.00、34.20、31.90、36.40、33.00、32.80、33.50 | 55.35、64.45、76.85、82.25、90.25、94.63、98.20、104.83、106.28、115.43、120.20、126.38、127.66 | 8.90、11.53、12.46、10.26、11.90、10.84、14.01、10.20、10.52、12.20、9.83、10.38 |
| 叶片宽度/mm | 29.44 | 16.32 | 13.12 | 24.61 | 2.19 |
| 花蕾长度/mm | 153 | 91 | 62 | 127 | 1.27 |
| 花蕾直径/mm | 13.07 | 8.11 | 4.96 | 10.42 | 1.08 |
| 花蕾鲜重/g | 6.17 | 1.92 | 4.25 | 3.79 | 0.84 |
| 薹蕾数/(蕾/薹) | 59.00 | 18.00 | 41.00 | 40.10 | 11.48 |
| 花葶高度/cm | 133.90 | 86.50 | 47.40 | 118.57 | 16.12 |
| 花葶鲜重/g | 45.47 | 25.02 | 20.45 | 38.48 | 7.14 |
1.2 模型构建方法
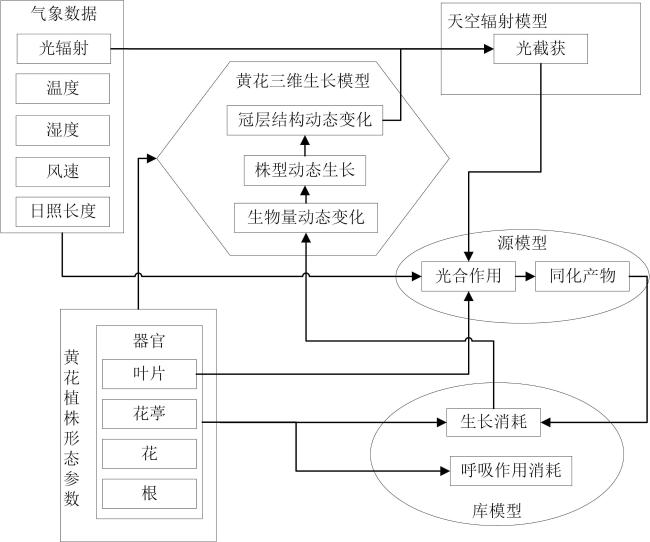
1.2.1 黄花结构-功能模拟模型的建立
1.2.2 天空辐射模型
1.2.3 黄花三维生长模型构建
1.2.4 源库关系模型
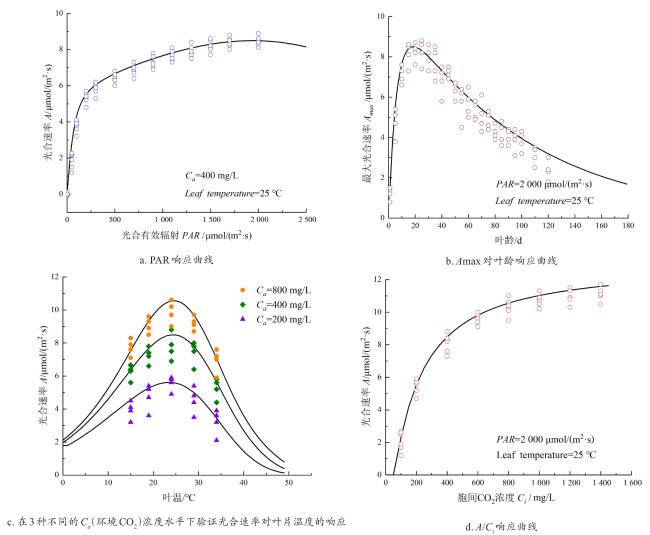
1.2.5 光合作用模型
表2 黄花植物功能-结构模型中的能量平衡方程、光合作用模型(FvCB模型[31])、气孔导度(BWB模型[32])Table 2 Equations of the modules for energy balance, photosynthesis (FvCB model), stomatal conductance (BWB model) in the plant functional-structural model of daylily and nomenclature |
| 模型类型 | 公式 | 描述 |
|---|---|---|
| 叶片能量平衡模型 | (6) | 叶片温度 的能量平衡方程 |
| (7) | 叶片辐射电导 | |
| (8) | 用于叶片传热计算的叶边界层电导 | |
| (9) | 叶片边界层电导 | |
| (10) | 在T ℃下的叶饱和蒸气压 | |
| (11) | 叶片蒸腾速率 | |
| 光合作用模型(FvCB模型) | (12) | 净光合速率 |
| (13) | Rubisco限制条件下光合速率 | |
| (14) | RuBP再生限制条件下光合速率 | |
| (15) | 电子传输速率的光依赖性 | |
| (16) | 光系统II对PAR的吸收 | |
| (17) | TPU限制条件下光合速率 | |
| (18) | Arrhenius函数; 的温度依赖性 | |
| (19) | 的温度依赖性 | |
| (20) | 的温度依赖性 | |
| (21) | 和 的叶龄依赖性 | |
| (22) | 胞间CO2浓度 | |
| (23) | 叶绿体内CO2浓度 | |
| (24) | 叶肉细胞对于CO2的电导 | |
| 气孔导度模型(BWB模型) | (25) | 气孔导度 |
| (26) | CO2补偿点,考虑呼吸作用(Rd ) | |
| (27) | 叶片表面CO2分压 | |
| (Gr/Re2 >1) (28) (Gr/Re2 <1) (29) (30) | 水蒸气的边界层电导 | |
| 其中 (31) | 与扩散方程相结合得到的二次方程 |
表3 黄花植物功能-结构模型中的能量平衡方程、光合作用模型和气孔导度符号说明Table 3 Symbol specification of the modules for energy balance, photosynthesis, stomatal conductance in the plant functional-structural model of daylily and nomenclature |
| 符号类型 | 符号 | 含义及单位 |
|---|---|---|
| 光合作用 | 存在Rd 时的CO2补偿点[μbar] | |
| 无Rd 时的CO2补偿点[μbar] | ||
| 以展开后的天数计算的叶龄[day] | ||
| 电子传递对PAR的响应曲率[0.7,-] | ||
| 叶反射率加上透射率 [0.15,-] | ||
| 叶片净光合速率[μmol/(m2·s)] | ||
| Rubisco限制的CO2同化率[μmol/(m2·s)] | ||
| 电子传输限制的CO2同化率[μmol/(m2·s) ] | ||
| 环境条件下光饱和CO2同化速率 [CO2] [μmol/(m2·s)] | ||
| 磷酸丙糖再利用受限的CO2同化率[μmol/(m2·s)] | ||
| 空气CO2分压 | ||
| 细胞间CO2分压[μbar] | ||
| 叶龄效应的比例因子[1.296,-] | ||
| 叶龄效应生长的经验系数[0.146 8,-] | ||
| 叶龄效应下降斜率的经验系数[0.010 3,-] | ||
| 活化能[kJ/mol] | ||
| 光谱校正因子[0.15,-] | ||
| 温度依赖性的曲率参数[219.4 kJ/mol] | ||
| 入射PAR [μmol photons/(m2·s)] | ||
| 光合电子传递速率[μmol electrons/(m2·s)] | ||
| 25 °C 时电子传输的潜在速率[36.8 μmol/(m2·s)] | ||
| CO2的Rubisco-Michaelis-Menten常数[267 μbar] | ||
| 25 °C时O2的Rubisco-Michaelis-Menten常数 [164 mbar] | ||
| O | 氧分压 [205 mbar ] | |
| 25 °C时磷酸丙糖利用率[10.35 μmol/(m2·s)] | ||
| R | 通用气体常数[8.314 J/(mol·K)[31]] | |
| 25 °C时光照条件下的线粒体呼吸作用 [0.0089Vcmax25 ] | ||
| S | 电子传输温度响应参数[704.2 J/(mol·K)] | |
| 羧化率 [μmol/(m2·s)] | ||
| 25 °C时的光合Rubisco潜力[92.07 μmol/(m2·s)] | ||
| 氧合率 [μmol/(m2·s)] | ||
| 温度相关的变量 | E | 每个过程的活化能 |
| 最大电子传输速率[μmol/(m2·s)] | ||
| CO2的Rubisco-Michaelis-Menten常数 [μmol/(m2·s)] EKc 80 990 | ||
| O2的Rubisco-Michaelis-Menten常数 [μmol/(m2·s)] EKo 36 000 | ||
| 磷酸丙糖利用率[μmol/(m2·s)] EPu 47 140.1 | ||
| 光下的线粒体呼吸速率[μmol/(m2·s)] ERd 46 390 | ||
| Rubisco羧化的最大速率[μmol/(m2·s)] EVcmax 65 330 | ||
| 气孔导度 模型 | b | 光补偿点时BWB模型对水汽的最小气孔导度[0.096 0 mol/(m2·s)] |
| 环境CO2分压[μbar] | ||
| 叶面CO2分压[μbar] | ||
| 边界层对水蒸气的电导[mol/(m2·s)] | ||
| 气孔对水蒸气的导度[mol/(m2·s)] | ||
| 用于传热的叶片边界层传导率[mol/(m2·s)] | ||
| 叶边界层电导[] | ||
| 叶面相对湿度[] | ||
| m | BWB模型中gs 对A、Cs 和hs 敏感度的经验系数[10.055,-] | |
| 能量平衡 方程 | 叶片热发射率[0.97] | |
| 斯特藩-玻尔兹曼常数 [ ] | ||
| 25 ℃时的潜热[44.0 kJ/mol] | ||
| 空气的比热容[29.3 J/(mol·℃)] | ||
| D | 环境空气的水蒸气压差[kPa] | |
| 叶片表面的水蒸气压差[kPa] | ||
| E | 单位叶面积的蒸腾速率[mol/(m2·s)] | |
| 单位投影叶面积的蒸腾速率[kPa] | ||
| 叶片表面的水蒸气压力[kPa] | ||
| 边界层单位表面叶面积的热传导率[mol/(m2·s)] | ||
| 单位表面叶面积的辐射传导率[mol/(m2·s)] | ||
| 单位表面叶面积的总水蒸气传导率[mol/(m2·s)] | ||
| 大气压力[kPa] | ||
| 单位表面叶面积吸收的长波和短波辐射能量 [W/m2] | ||
| 周围空气温度[℃] |
2 结果与分析
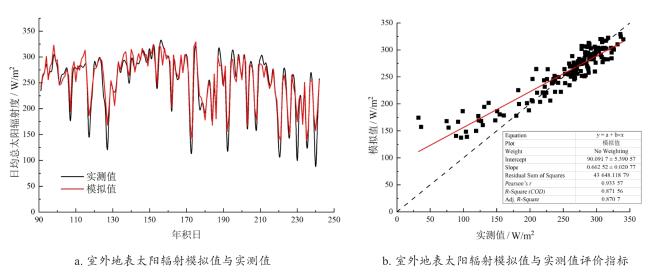
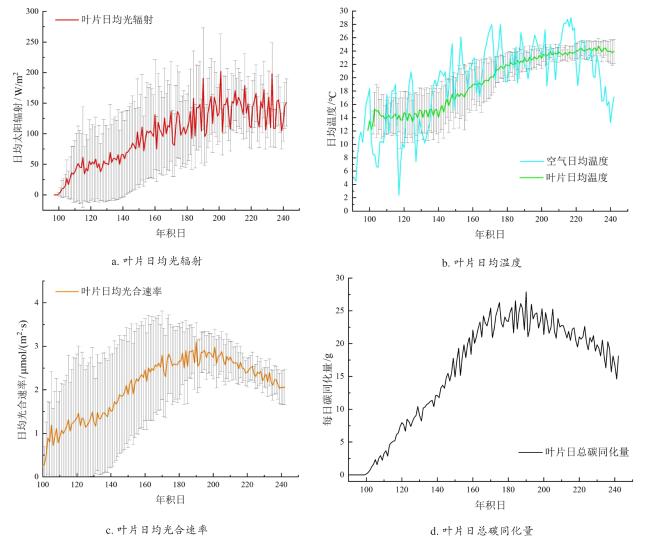
2.1 基于云量的室外地表太阳辐射模拟及光合作用模拟验证
图3 基于云量的室外地表太阳辐射模拟值与实测值比较及其评价指标Fig. 3 Comparison and evaluation of simulated and measured outdoor surface solar radiation based on cloud cover |
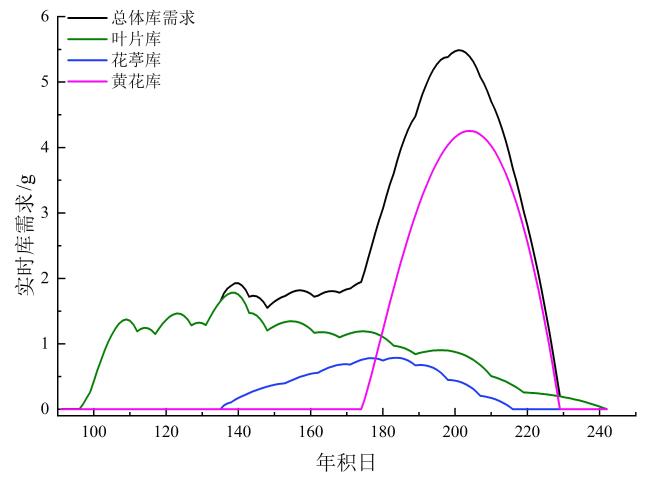
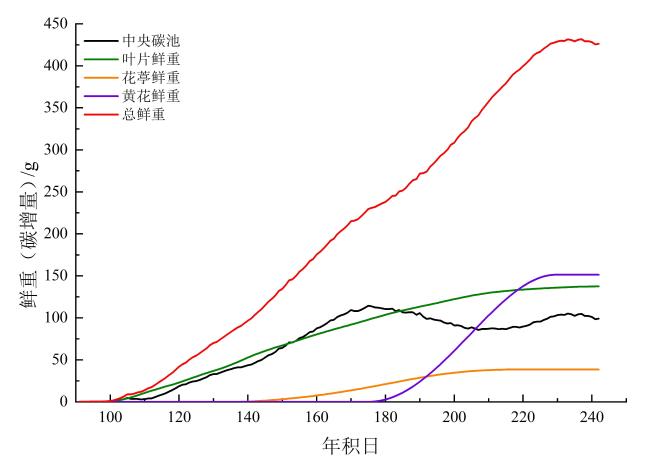
2.2 黄花植株生长源库关系模拟
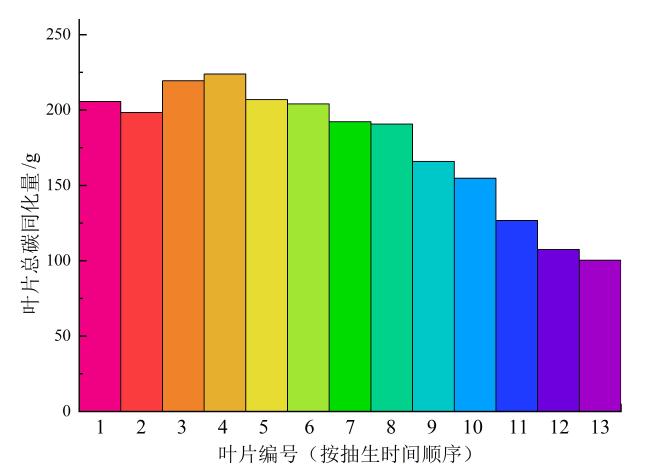
2.3 黄花植株不同生长期各器官生长情况模拟及产量模拟
表3 黄花各器官形态及产量指标生长过程实测值与模拟值比较Table 3 Comparison between measured and simulated values of morphological and yield indices growth process for various organs in daylily |
| 类别 | R 2 | RMSE | F | Sig. |
|---|---|---|---|---|
| 叶位1 | 0.984 | 0.028 | 304.046 | 1.14×10-5 |
| 叶位2 | 0.943 | 0.064 | 82.244 | 2.73×10-4 |
| 叶位3 | 0.980 | 0.057 | 344.191 | 3.28×10-7 |
| 叶位4 | 0.938 | 0.083 | 106.812 | 1.72×10-5 |
| 叶位5 | 0.916 | 0.142 | 109.306 | 1.06×10-6 |
| 叶位6 | 0.938 | 0.111 | 166.137 | 5.56×10-8 |
| 叶位7 | 0.919 | 0.177 | 158.659 | 5.01×10-9 |
| 叶位8 | 0.896 | 0.144 | 138.523 | 2.72×10-9 |
| 叶位9 | 0.934 | 0.111 | 270.099 | 1.09×10-12 |
| 叶位10 | 0.920 | 0.123 | 230.845 | 1.9×10-12 |
| 叶位11 | 0.951 | 0.123 | 508.713 | 1.35×10-18 |
| 叶位12 | 0.909 | 0.147 | 278.480 | 4.41×10-16 |
| 叶位13 | 0.926 | 0.129 | 426.891 | 7.99×10-21 |
| 花葶长 | 0.972 | 0.088 | 1 168.533 | 6.49×10-28 |
| 平均花蕾长 | 0.914 | 0.014 | 211.946 | 9.72×10-12 |
| 平均花蕾鲜重 | 0.880 | 0.511 | 146.685 | 1.15×10-10 |