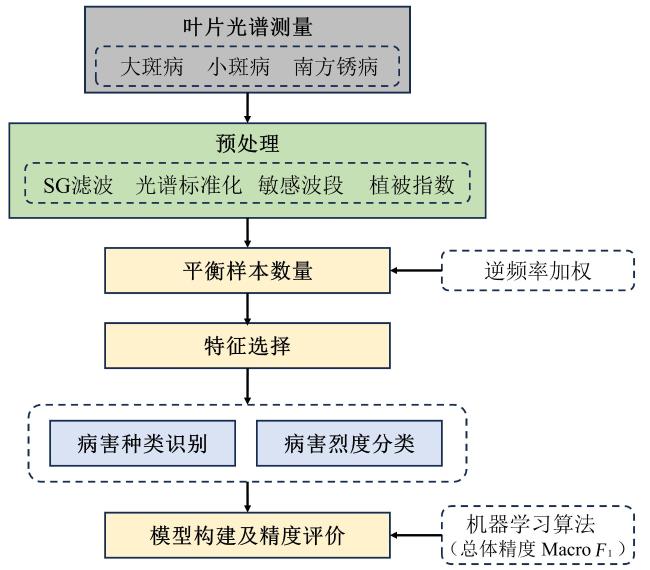
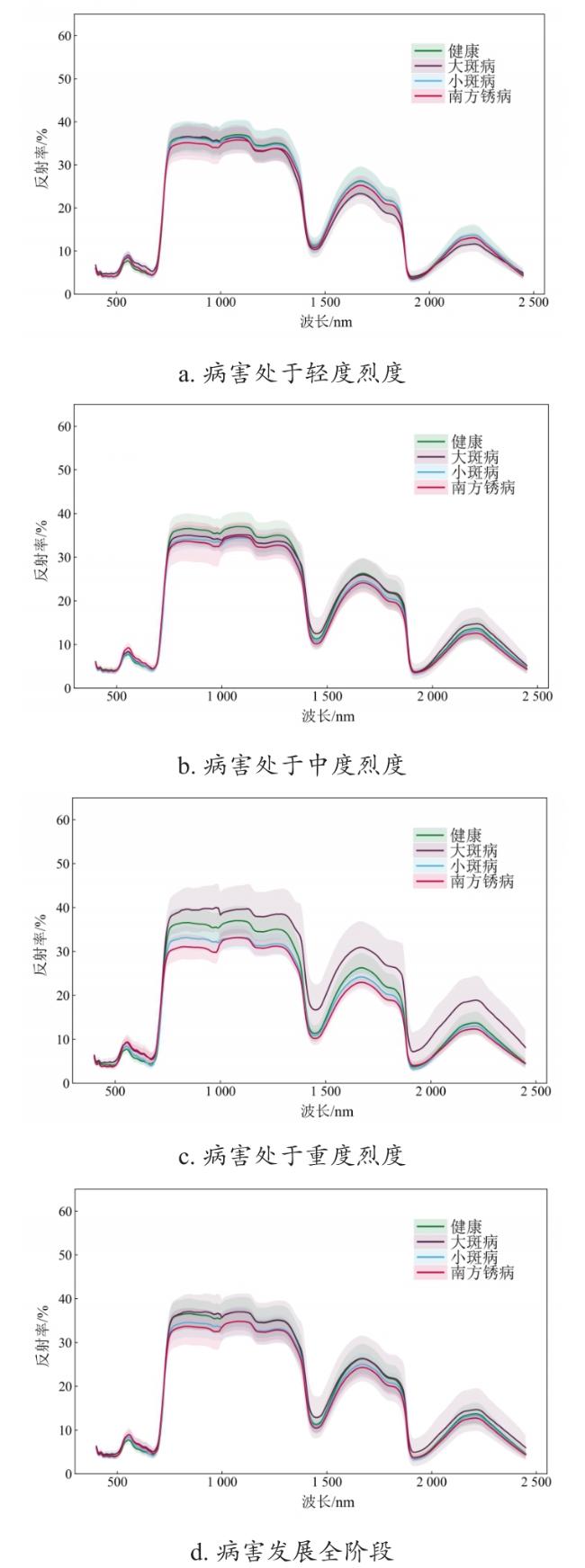
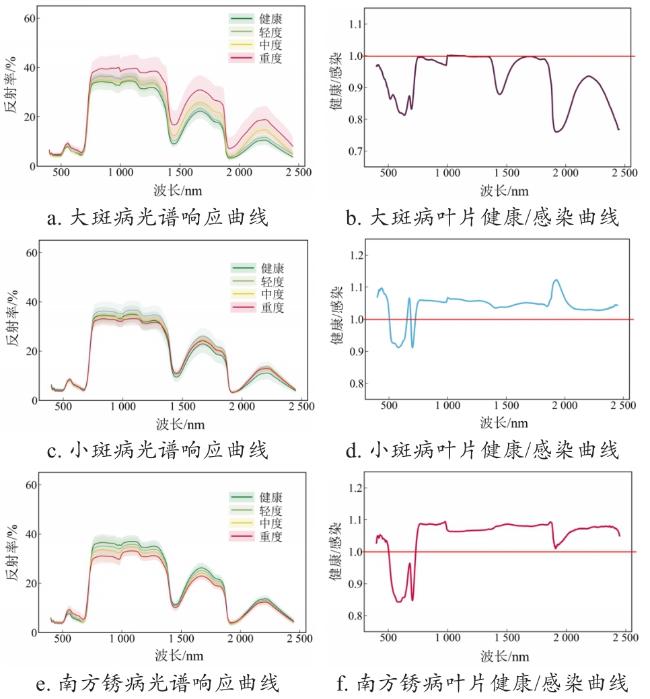
[Objective] In recent years, there has been a significant increase in the severity of leaf diseases in maize, with a noticeable trend of mixed occurrence. This poses a serious threat to the yield and quality of maize. However, there is a lack of studies that combine the identification of different types of leaf diseases and their severity classification, which cannot meet the needs of disease prevention and control under the mixed occurrence of different diseases and different severities in actual maize fields. [Methods] A method was proposed for identifying the types of typical leaf diseases in maize and classifying their severity using hyperspectral technology. Hyperspectral data of three leaf diseases of maize: northern corn leaf blight (NCLB), southern corn leaf blight (SCLB) and southern corn rust (SCR), were obtained through greenhouse pathogen inoculation and natural inoculation. The spectral data were preprocessed by spectral standardization, SG filtering, sensitive band extraction and vegetation index calculation, to explore the spectral characteristics of the three leaf diseases of maize. Then, the inverse frequency weighting method was utilized to balance the number of samples to reduce the overfitting phenomenon caused by sample imbalance. Relief-F and variable selection using random forests (VSURF) method were employed to optimize the sensitive spectral features, including band features and vegetation index features, to construct models for disease type identification based on the full stages of disease development (including all disease severities) and for individual disease severities using several representative machine learning approaches, demonstrating the effectiveness of the research method. Furthermore, the study individual occurrence severity classification models were also constructed for each single maize leaf disease, including the NCLB, SCLB and SCR severity classification models, respectively, aiming to achieve full-process recognition and disease severity classification for different leaf diseases. Overall accuracy (OA) and Macro F1 were used to evaluate the model accuracy in this study. Results and Discussion The research results showed significant spectrum changes of three kinds of maize leaf diseases primarily focusing on the visible (550-680 nm), red edge (740-760 nm), near-infrared (760-1 000 nm) and shortwave infrared (1 300-1 800 nm) bands. Disease-specific spectral features, optimized based on disease spectral response rules, effectively identified disease species and classify their severity. Moreover, vegetation index features were more effective in identifying disease-specific information than sensitive band features. This was primarily due to the noise and information redundancy present in the selected hyperspectral sensitive bands, whereas vegetation index could reduce the influence of background and atmospheric noise to a certain extent by integrating relevant spectral signals through band calculation, so as to achieve higher precision in the model. Among several machine learning algorithms, the support vector machine (SVM) method exhibited better robustness than random forest (RF) and decision tree (DT). In the full stage of disease development, the optimal overall accuracy (OA) of the disease classification model constructed by SVM based on vegetation index reached 77.51%, with a Macro F1 of 0.77, representing a 28.75% increase in OA and 0.30 higher of Macro F1 compared to the model based on sensitive bands. Additionally, the accuracy of the disease classification model with a single severity of the disease increased with the severity of the disease. The accuracy of disease classification during the early stage of disease development (OA=70.31%) closely approached that of the full disease development stage (OA=77.51%). Subsequently, in the moderate disease severity stage, the optimal accuracy of disease classification (OA=80.00%) surpassed the optimal accuracy of disease classification in the full disease development stage. Furthermore, the optimal accuracy of disease classification under severe severity reached 95.06%, with a Macro F1 of 0.94. This heightened accuracy during the severity stage can be attributed to significant changes in pigment content, water content and cell structure of the diseased leaves, intensifying the spectral response of each disease and enhancing the differentiation between different diseases. In disease severity classification model, the optimal accuracy of the three models for maize leaf disease severity all exceeded 70%. Among the three kinds of disease severity classification results, the NCLB severity classification model exhibited the best performance. The NCLB severity classification model, utilizing SVM based on the optimal vegetation index features, achieved an OA of 86.25%, with a Macro F1 of 0.85. In comparison, the accuracy of the SCLB severity classification model (OA=70.35%, Macro F1=0.70) and SCR severity classification model (OA=71.39%, Macro F1=0.69) were lower than that of NCLB. [Conclusions] The aforementioned results demonstrate the potential to effectively identify and classify the types and severity of common leaf diseases in maize using hyperspectral data. This lays the groundwork for research and provides a theoretical basis for large-scale crop disease monitoring, contributing to precision prevention and control as well as promoting green agriculture.