智慧农业发展现状及战略目标研究
1
2019
... 农业是与人类生活息息相关的产业,是国民经济的重要支柱.智慧农业需要更为快速、先进、准确的传感器来获取动植物的表型特征,让农业生产更加“聪明”和“智慧”[1].农业产业链中面临着种种问题:在农产品生产、收获、加工以及销售的一系列流程中,农作物的生长状况、农产品的产量及加工流程等均需要进行实时监测;农药的使用可能导致农产品存在农药残留,威胁人类健康;在食品加工过程中,厂家为了提升经济利益而在食品中掺假的情况时有发生.传统的检测手段需要对样品进行前处理,耗时、费力、破坏样品,运用快速、无损、在线的测量方法来解决上述农业中的监测和检测难题成为热点. ...
State-of-the-art and recommended developmental strategic objectivs of smart agriculture
1
2019
... 农业是与人类生活息息相关的产业,是国民经济的重要支柱.智慧农业需要更为快速、先进、准确的传感器来获取动植物的表型特征,让农业生产更加“聪明”和“智慧”[1].农业产业链中面临着种种问题:在农产品生产、收获、加工以及销售的一系列流程中,农作物的生长状况、农产品的产量及加工流程等均需要进行实时监测;农药的使用可能导致农产品存在农药残留,威胁人类健康;在食品加工过程中,厂家为了提升经济利益而在食品中掺假的情况时有发生.传统的检测手段需要对样品进行前处理,耗时、费力、破坏样品,运用快速、无损、在线的测量方法来解决上述农业中的监测和检测难题成为热点. ...
A new radiation
1
1928
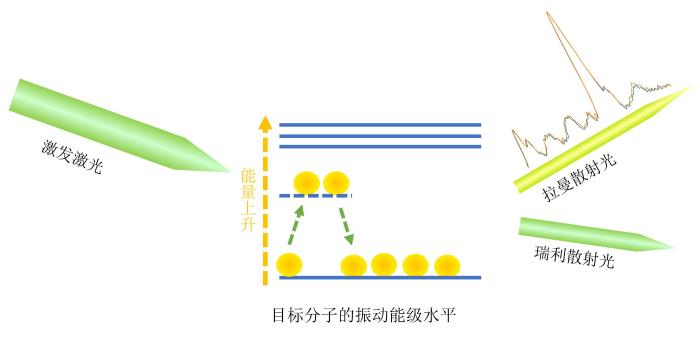
... 1928年,印度科学家C.V. Raman发现了光的非弹性散射现象,称为拉曼效应[2].拉曼光谱是基于激发光谱和待测分子之间的拉曼效应所获得的光谱.拉曼光谱测量分子的振动与转动,拉曼频移大小与入射光源波长无关,通过谱峰的位置可反映被测物质分子的官能团或化学键的特征振动频率.因此,拉曼光谱被称为“分子指纹”.作为一种强有力的分子检测手段,拉曼光谱技术可实现样本快速、无损检测[3-5].此外,水分子的拉曼散射效应较弱,在测量中,拉曼光谱不易受水分子的干扰.这使得拉曼光谱能够用于含水生命体的测量[5].拉曼光谱的测量原理如图1所示. ...
1
1989
... 1928年,印度科学家C.V. Raman发现了光的非弹性散射现象,称为拉曼效应[2].拉曼光谱是基于激发光谱和待测分子之间的拉曼效应所获得的光谱.拉曼光谱测量分子的振动与转动,拉曼频移大小与入射光源波长无关,通过谱峰的位置可反映被测物质分子的官能团或化学键的特征振动频率.因此,拉曼光谱被称为“分子指纹”.作为一种强有力的分子检测手段,拉曼光谱技术可实现样本快速、无损检测[3-5].此外,水分子的拉曼散射效应较弱,在测量中,拉曼光谱不易受水分子的干扰.这使得拉曼光谱能够用于含水生命体的测量[5].拉曼光谱的测量原理如图1所示. ...
Zur quantentheorie der dispersion
0
1923
A new type of secondary radiation
2
1928
... 1928年,印度科学家C.V. Raman发现了光的非弹性散射现象,称为拉曼效应[2].拉曼光谱是基于激发光谱和待测分子之间的拉曼效应所获得的光谱.拉曼光谱测量分子的振动与转动,拉曼频移大小与入射光源波长无关,通过谱峰的位置可反映被测物质分子的官能团或化学键的特征振动频率.因此,拉曼光谱被称为“分子指纹”.作为一种强有力的分子检测手段,拉曼光谱技术可实现样本快速、无损检测[3-5].此外,水分子的拉曼散射效应较弱,在测量中,拉曼光谱不易受水分子的干扰.这使得拉曼光谱能够用于含水生命体的测量[5].拉曼光谱的测量原理如图1所示. ...
... [5].拉曼光谱的测量原理如图1所示. ...
Studying single living cells and chromosomes by confocal Raman microspectroscopy
2
1990
... 共聚焦显微拉曼光谱是将共聚焦技术、拉曼光谱技术、显微技术三者相融合,能够在微米级尺度的空间中对样品进行拉曼高光谱成像,实现对样品的化学组成以及空间分布的同步分析[6].共聚焦技术配置针孔,可在样品X轴、Y轴(横纵向)和Z(深度)轴上进行空间滤波,能够有效地滤除杂散光,提高信噪比.因此,共聚焦显微拉曼光谱技术成像清晰,具有高空间分辨率,已广泛应用于生命科学领域微观尺度的研究[6,7].长焦拉曼光谱仪还具有很高的光谱分辨率,从而能够区分更多物质的特征峰,应用于更为复杂的混合物质的检测中. ...
... [6,7].长焦拉曼光谱仪还具有很高的光谱分辨率,从而能够区分更多物质的特征峰,应用于更为复杂的混合物质的检测中. ...
Species-independent analytical tools for next-generation agriculture
1
2020
... 共聚焦显微拉曼光谱是将共聚焦技术、拉曼光谱技术、显微技术三者相融合,能够在微米级尺度的空间中对样品进行拉曼高光谱成像,实现对样品的化学组成以及空间分布的同步分析[6].共聚焦技术配置针孔,可在样品X轴、Y轴(横纵向)和Z(深度)轴上进行空间滤波,能够有效地滤除杂散光,提高信噪比.因此,共聚焦显微拉曼光谱技术成像清晰,具有高空间分辨率,已广泛应用于生命科学领域微观尺度的研究[6,7].长焦拉曼光谱仪还具有很高的光谱分辨率,从而能够区分更多物质的特征峰,应用于更为复杂的混合物质的检测中. ...
Fourier transform Raman spectroscopy
1
1986
... 拉曼信号易受样品中发色团荧光信号的干扰.傅里叶变换拉曼光谱是近红外激发拉曼技术与傅里叶变换技术的结合,在1986年由赫希Hirschfeld(非尔德)和Chase(蔡斯)首次实际应用[8].傅里叶变换拉曼光谱技术由于没有经过光栅色散,这种技术的信噪比在其他测量参数相同的情况下一般高于色散型光谱仪.傅里叶变换拉曼光谱通常以1064 nm激光作为激发光源,可以极大地降低样品的荧光信号,有效避免荧光对拉曼散射的干扰,提升拉曼光谱的信号强度和信噪比[9].有研究者总结了将此项技术应用在食品领域的潜力研究[10].近些年来,也有研究者将可见波段的激光与傅里叶光谱仪结合[11],有望成为一种新的发展趋势. ...
Potential of near-infrared Fourier transform Raman spectroscopy in food analysis
1
1992
... 拉曼信号易受样品中发色团荧光信号的干扰.傅里叶变换拉曼光谱是近红外激发拉曼技术与傅里叶变换技术的结合,在1986年由赫希Hirschfeld(非尔德)和Chase(蔡斯)首次实际应用[8].傅里叶变换拉曼光谱技术由于没有经过光栅色散,这种技术的信噪比在其他测量参数相同的情况下一般高于色散型光谱仪.傅里叶变换拉曼光谱通常以1064 nm激光作为激发光源,可以极大地降低样品的荧光信号,有效避免荧光对拉曼散射的干扰,提升拉曼光谱的信号强度和信噪比[9].有研究者总结了将此项技术应用在食品领域的潜力研究[10].近些年来,也有研究者将可见波段的激光与傅里叶光谱仪结合[11],有望成为一种新的发展趋势. ...
Fourier transform Raman spectroscopy
1
1987
... 拉曼信号易受样品中发色团荧光信号的干扰.傅里叶变换拉曼光谱是近红外激发拉曼技术与傅里叶变换技术的结合,在1986年由赫希Hirschfeld(非尔德)和Chase(蔡斯)首次实际应用[8].傅里叶变换拉曼光谱技术由于没有经过光栅色散,这种技术的信噪比在其他测量参数相同的情况下一般高于色散型光谱仪.傅里叶变换拉曼光谱通常以1064 nm激光作为激发光源,可以极大地降低样品的荧光信号,有效避免荧光对拉曼散射的干扰,提升拉曼光谱的信号强度和信噪比[9].有研究者总结了将此项技术应用在食品领域的潜力研究[10].近些年来,也有研究者将可见波段的激光与傅里叶光谱仪结合[11],有望成为一种新的发展趋势. ...
A Fourier transform Raman spectrometer with visible laser excitation
1
2015
... 拉曼信号易受样品中发色团荧光信号的干扰.傅里叶变换拉曼光谱是近红外激发拉曼技术与傅里叶变换技术的结合,在1986年由赫希Hirschfeld(非尔德)和Chase(蔡斯)首次实际应用[8].傅里叶变换拉曼光谱技术由于没有经过光栅色散,这种技术的信噪比在其他测量参数相同的情况下一般高于色散型光谱仪.傅里叶变换拉曼光谱通常以1064 nm激光作为激发光源,可以极大地降低样品的荧光信号,有效避免荧光对拉曼散射的干扰,提升拉曼光谱的信号强度和信噪比[9].有研究者总结了将此项技术应用在食品领域的潜力研究[10].近些年来,也有研究者将可见波段的激光与傅里叶光谱仪结合[11],有望成为一种新的发展趋势. ...
Raman spectra of pyridine adsorbed at a silver electrode
1
1974
... 表面增强拉曼效应最早由Fleischmann等[12]在1974年发现,它推动了增强拉曼光谱技术的研究.表面增强拉曼光谱技术(Surface Enhanced Raman Spectroscopy,SERS)解决了自发拉曼光谱检测灵敏度低的问题.当待测分子吸附在粗糙的金属材料表面时,可使待测物的拉曼信号有效增强.其增强机制可分为物理增强和化学增强[13].SERS活性基底的制备是获得增强拉曼信号的前提条件,只有金、银、铜等少数金属基底才具有很强的SERS效应.随着纳米科技的发展,SERS基底的制备方法取得了巨大的进步.不同的增强基底对样品的增强效果差别很大,因此针对特定分析物研制合适的基底有利于提高检测灵敏度和稳定性.比如对于痕量物质,需要在基底上涂有富集功能的材料以实现痕量物质的检测;对于金属亲和性不强的待测物质,需要有核酸适配体等其他物质的修饰进行亲和富集. ...
Synergetic SERS enhancement in a metal-like/metal double-shell structure for sensitive and stable application
1
2017
... 表面增强拉曼效应最早由Fleischmann等[12]在1974年发现,它推动了增强拉曼光谱技术的研究.表面增强拉曼光谱技术(Surface Enhanced Raman Spectroscopy,SERS)解决了自发拉曼光谱检测灵敏度低的问题.当待测分子吸附在粗糙的金属材料表面时,可使待测物的拉曼信号有效增强.其增强机制可分为物理增强和化学增强[13].SERS活性基底的制备是获得增强拉曼信号的前提条件,只有金、银、铜等少数金属基底才具有很强的SERS效应.随着纳米科技的发展,SERS基底的制备方法取得了巨大的进步.不同的增强基底对样品的增强效果差别很大,因此针对特定分析物研制合适的基底有利于提高检测灵敏度和稳定性.比如对于痕量物质,需要在基底上涂有富集功能的材料以实现痕量物质的检测;对于金属亲和性不强的待测物质,需要有核酸适配体等其他物质的修饰进行亲和富集. ...
Advanced application of Raman spectroscopy and surface-enhanced Raman spectroscopy in plant disease diagnostics: A review
1
2021
... SERS技术已经应用于植物中提取的激素等分子的分析检测及植物病原体检测等方面[14].它的优势在于具有很高的灵敏度,相比于自发拉曼光谱,SERS的光谱强度可以增强3~4个数量级,因此具有更低的检测限.但是传统的SERS技术稳定性较低,尤其是在定量分析中,难以获得稳定的定量结果,同时,由于基板的光热效应,容易损伤待检测的生物分子,具有很低的生物相容性.因此,提升定性和定量的稳定性是下一步SERS技术的发展方向. ...
Raman spectroscopy: Recent advancements, techniques and applications
1
2011
... 普通显微拉曼光谱技术由于光学衍射极限和探测器灵敏度的限制,很难直接应用于纳米尺度表征.针尖增强拉曼光谱技术是将扫描探针显微镜与SERS相结合,具有高灵敏度和高空间分辨率[15].当入射光照射在纳米尺度的尖锐金属探针尖端时,在局域表面等离激元共振效应、避雷针效应和天线效应的共同作用下,针尖附近几纳米到十几纳米范围内会产生强烈的局域电磁场增强,增强针尖下方样品的拉曼信号[16].通过扫描探针显微镜操作针尖在样品上方的扫描,能够实现样品表面纳米尺度的形貌表征和纳米局域拉曼光谱同步探测. ...
Tip-enhanced Raman scattering
1
2008
... 普通显微拉曼光谱技术由于光学衍射极限和探测器灵敏度的限制,很难直接应用于纳米尺度表征.针尖增强拉曼光谱技术是将扫描探针显微镜与SERS相结合,具有高灵敏度和高空间分辨率[15].当入射光照射在纳米尺度的尖锐金属探针尖端时,在局域表面等离激元共振效应、避雷针效应和天线效应的共同作用下,针尖附近几纳米到十几纳米范围内会产生强烈的局域电磁场增强,增强针尖下方样品的拉曼信号[16].通过扫描探针显微镜操作针尖在样品上方的扫描,能够实现样品表面纳米尺度的形貌表征和纳米局域拉曼光谱同步探测. ...
Resolving the sequence of RNA strands by Tip-Enhanced Raman Spectroscopy
1
2020
... 针尖增强拉曼光谱技术已经应用于检测RNA序列[17]、农药[18]、细菌、病毒等[19,20]等多个方面.这一技术的优势是可以提供更高的空间分辨率,甚至可以达到纳米级的空间分辨.可在分子水平上进行科学研究,为纳米尺度的化学分析和成像开辟了新的可能.由于针尖区域的磁场增强,可以具有更高的灵敏度和更低的检测限.测量稳定的结果需要制备外形尺寸一致、光学特性可精确控制、可长期保存并且使用的高质量TERS(Tip Enhanced Raman Spectroscopy)探针,但是当前的技术并不能完全达到这一要求. ...
Novel approaches in tip-enhanced Raman spectroscopy: Accurate measurement of enhancement factors and pesticide detection in tip dimer configuration
1
2019
... 针尖增强拉曼光谱技术已经应用于检测RNA序列[17]、农药[18]、细菌、病毒等[19,20]等多个方面.这一技术的优势是可以提供更高的空间分辨率,甚至可以达到纳米级的空间分辨.可在分子水平上进行科学研究,为纳米尺度的化学分析和成像开辟了新的可能.由于针尖区域的磁场增强,可以具有更高的灵敏度和更低的检测限.测量稳定的结果需要制备外形尺寸一致、光学特性可精确控制、可长期保存并且使用的高质量TERS(Tip Enhanced Raman Spectroscopy)探针,但是当前的技术并不能完全达到这一要求. ...
On the way to nanometer-sized information of the bacterial surface by tip-enhanced Raman spectroscopy
1
2006
... 针尖增强拉曼光谱技术已经应用于检测RNA序列[17]、农药[18]、细菌、病毒等[19,20]等多个方面.这一技术的优势是可以提供更高的空间分辨率,甚至可以达到纳米级的空间分辨.可在分子水平上进行科学研究,为纳米尺度的化学分析和成像开辟了新的可能.由于针尖区域的磁场增强,可以具有更高的灵敏度和更低的检测限.测量稳定的结果需要制备外形尺寸一致、光学特性可精确控制、可长期保存并且使用的高质量TERS(Tip Enhanced Raman Spectroscopy)探针,但是当前的技术并不能完全达到这一要求. ...
Raman to the limit: Tip-enhanced Raman spectroscopic investigations of a single tobacco mosaic virus
1
2009
... 针尖增强拉曼光谱技术已经应用于检测RNA序列[17]、农药[18]、细菌、病毒等[19,20]等多个方面.这一技术的优势是可以提供更高的空间分辨率,甚至可以达到纳米级的空间分辨.可在分子水平上进行科学研究,为纳米尺度的化学分析和成像开辟了新的可能.由于针尖区域的磁场增强,可以具有更高的灵敏度和更低的检测限.测量稳定的结果需要制备外形尺寸一致、光学特性可精确控制、可长期保存并且使用的高质量TERS(Tip Enhanced Raman Spectroscopy)探针,但是当前的技术并不能完全达到这一要求. ...
Raman spectroscopy: Recent advancements, techniques and applications
1
2011
... 共振拉曼光谱是将激发光的能量调整到待测物电子跃迁能量附近以达到共振效果.但是共振激发波长一般位于紫外-可见光区域,因此共振拉曼光谱的荧光背景也会更加显著,这种方法容易受到荧光的干扰[21-23]. ...
Resonance Raman spectroscopy
0
1977
Resonance Raman spectroscopy
1
2009
... 共振拉曼光谱是将激发光的能量调整到待测物电子跃迁能量附近以达到共振效果.但是共振激发波长一般位于紫外-可见光区域,因此共振拉曼光谱的荧光背景也会更加显著,这种方法容易受到荧光的干扰[21-23]. ...
Resonance Raman scattering of β-carotene solution excited by visible laser beams into second singlet state
1
2018
... 共振拉曼光谱技术已经成功应用于植物色素的检测中,例如典型的类胡萝卜素,在可见光区域使用532、514.4和488 nm的激光都能够产生共振增强的效果,信号强度可增强2~6个数量级,因此具有更高的灵敏度[24,25].由于激发光谱能够激发待测分子的电子能级跃迁,因此这一技术获取的拉曼光谱通常伴有较强的荧光背景.采用预共振的激发光波长能够减弱荧光背景,但是减弱的幅度有限. ...
Resonance Raman spectroscopy of carotenoids and carotenoid-containing systems
1
1985
... 共振拉曼光谱技术已经成功应用于植物色素的检测中,例如典型的类胡萝卜素,在可见光区域使用532、514.4和488 nm的激光都能够产生共振增强的效果,信号强度可增强2~6个数量级,因此具有更高的灵敏度[24,25].由于激发光谱能够激发待测分子的电子能级跃迁,因此这一技术获取的拉曼光谱通常伴有较强的荧光背景.采用预共振的激发光波长能够减弱荧光背景,但是减弱的幅度有限. ...
A novel approach for subsurface through-skin analysis of salmon using spatially offset Raman spectroscopy (SORS)
1
2014
... 空间偏移拉曼光谱已经应用于鲑鱼质量[26]和马铃薯块茎营养成分的非侵入性和非破坏性评估[27].这一技术的优势是可以在不破坏样品表层的情况下获得样品内部的物质成分信息,并对待测对象进行纵深方向上的成分分析,获取深层次的化学信息.但是对于激发光谱吸收严重的样品,会导致拉曼信号强度降低.同时相比于传统的自发拉曼光谱技术,需要更高量子效率的电荷耦合元件(Charge-Coupled Device,CCD)和复杂的光路设计,从而成本造价更高[28]. ...
Non-invasive identification of potato varieties and prediction of the origin of tuber cultivation using spatially offset Raman spectroscopy
1
2020
... 空间偏移拉曼光谱已经应用于鲑鱼质量[26]和马铃薯块茎营养成分的非侵入性和非破坏性评估[27].这一技术的优势是可以在不破坏样品表层的情况下获得样品内部的物质成分信息,并对待测对象进行纵深方向上的成分分析,获取深层次的化学信息.但是对于激发光谱吸收严重的样品,会导致拉曼信号强度降低.同时相比于传统的自发拉曼光谱技术,需要更高量子效率的电荷耦合元件(Charge-Coupled Device,CCD)和复杂的光路设计,从而成本造价更高[28]. ...
Spatially offset Raman spectroscopy
1
2021
... 空间偏移拉曼光谱已经应用于鲑鱼质量[26]和马铃薯块茎营养成分的非侵入性和非破坏性评估[27].这一技术的优势是可以在不破坏样品表层的情况下获得样品内部的物质成分信息,并对待测对象进行纵深方向上的成分分析,获取深层次的化学信息.但是对于激发光谱吸收严重的样品,会导致拉曼信号强度降低.同时相比于传统的自发拉曼光谱技术,需要更高量子效率的电荷耦合元件(Charge-Coupled Device,CCD)和复杂的光路设计,从而成本造价更高[28]. ...
Fluorescence rejection in Raman spectroscopy by shifted-spectra, edge detection, and FFT filtering techniques
1
1995
... 移频激发拉曼差分光谱是根据拉曼偏移与激发波长无关的特性,使用两个相近的激发波长激发样品获取光谱后做差分,分析得出拉曼光谱的技术.这种技术能够有效地降低测量的荧光背景,分析强度较弱的拉曼信号[29]. ...
Determination of soil constituents using shifted excitation Raman difference spectroscopy
1
2022
... 这一技术已经应用在土壤成分检测等方面[30],因为其独特的算法和光路的优势,能够大幅度降低荧光背景对拉曼信号的影响.但是这一技术需要双波长激光进行激发,因此需要更为复杂的光路设计,甚至需要两组光路,增加了系统的复杂性. ...
A review of the theory and application of coherent anti-Stokes Raman spectroscopy (CARS)
1
1977
... 基于非线性光学原理的两种拉曼光谱手段也可用于提升信噪比,分别叫做相干反斯托克斯拉曼光谱[31]和受激拉曼光谱[32]. ...
Label-free biomedical imaging with high sensitivity by stimulated Raman scattering microscopy
1
2008
... 基于非线性光学原理的两种拉曼光谱手段也可用于提升信噪比,分别叫做相干反斯托克斯拉曼光谱[31]和受激拉曼光谱[32]. ...
In vivo chemical and structural analysis of plant cuticular waxes using stimulated Raman scattering microscopy
1
2015
... 目前,基于非线性光学的拉曼光谱技术主要集中在快速成像上,应用较少.现已有受激拉曼光谱应用于植物叶片的角质层及木聚糖等物质的成像分析[33].相干反斯托克斯拉曼光谱技术也有应用于植物细胞壁的木质素的成像分析研究[34].受激拉曼光谱由于双光子共振效应增大了拉曼散射截面,提高拉曼激发效率,可以显著地提升信噪比.相干反斯托克斯拉曼光谱技术能够研究反斯托克斯散射,从而避免了荧光等其他因素的影响.两种技术都具有很快的光谱成像速度.但是两者的光学结构相对于自发拉曼光谱要复杂的多,甚至会用到飞秒激光器等设备,造价昂贵.以上所述拉曼光谱技术的优缺点对比如表1所示. ...
Imaging lignin-downregulated alfalfa using coherent anti-Stokes Raman scattering microscopy
1
2010
... 目前,基于非线性光学的拉曼光谱技术主要集中在快速成像上,应用较少.现已有受激拉曼光谱应用于植物叶片的角质层及木聚糖等物质的成像分析[33].相干反斯托克斯拉曼光谱技术也有应用于植物细胞壁的木质素的成像分析研究[34].受激拉曼光谱由于双光子共振效应增大了拉曼散射截面,提高拉曼激发效率,可以显著地提升信噪比.相干反斯托克斯拉曼光谱技术能够研究反斯托克斯散射,从而避免了荧光等其他因素的影响.两种技术都具有很快的光谱成像速度.但是两者的光学结构相对于自发拉曼光谱要复杂的多,甚至会用到飞秒激光器等设备,造价昂贵.以上所述拉曼光谱技术的优缺点对比如表1所示. ...
Pattern recognition-based Raman spectroscopy for non-destructive detection of pomegranates during maturity
1
2020
... 如何判断植物生长阶段是重要研究方向,在植物成熟的时候及时收获有助于提高经济效益.拉曼光谱可以用于检测水果的成熟度,Khodabakhshian等[35]以开花之后88 d到143 d的四个明显不同成熟阶段的石榴作为样本,基于傅里叶变换拉曼光谱进行分析,通过无监督算法主成分分析(Principal Components Analysis,PCA)将四种类型的石榴拉曼光谱区分开,采用有监督的算法偏最小二乘判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)和软独立模式分类法(Soft Independent Modeling of Class Analogy,SIMCA)进行分类分析,其中SIMCA可以达到82%的准确度,PLS-DA的训练集和验证集的准确度分别为96%和95%.当只采用“成熟”和“不成熟”两种类别时,基于PCA的SIMCA模型能够达到100%的分类准确度.拉曼光谱还可以通过水果表面检测内部的成熟程度,Qin等[36]探索了基于SORS无损评价番茄内部成熟度的方法,通过荧光校正后的偏移光谱的自建模混合分析,有效分离了外果皮层和特氟隆层的拉曼信号,检测到番茄内部的类胡萝卜素变化从而实现对番茄成熟度的区分. ...
Nondestructive evaluation of internal maturity of tomatoes using spatially offset Raman spectroscopy
1
2012
... 如何判断植物生长阶段是重要研究方向,在植物成熟的时候及时收获有助于提高经济效益.拉曼光谱可以用于检测水果的成熟度,Khodabakhshian等[35]以开花之后88 d到143 d的四个明显不同成熟阶段的石榴作为样本,基于傅里叶变换拉曼光谱进行分析,通过无监督算法主成分分析(Principal Components Analysis,PCA)将四种类型的石榴拉曼光谱区分开,采用有监督的算法偏最小二乘判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)和软独立模式分类法(Soft Independent Modeling of Class Analogy,SIMCA)进行分类分析,其中SIMCA可以达到82%的准确度,PLS-DA的训练集和验证集的准确度分别为96%和95%.当只采用“成熟”和“不成熟”两种类别时,基于PCA的SIMCA模型能够达到100%的分类准确度.拉曼光谱还可以通过水果表面检测内部的成熟程度,Qin等[36]探索了基于SORS无损评价番茄内部成熟度的方法,通过荧光校正后的偏移光谱的自建模混合分析,有效分离了外果皮层和特氟隆层的拉曼信号,检测到番茄内部的类胡萝卜素变化从而实现对番茄成熟度的区分. ...
Non-invasive identification of potato varieties and prediction of the origin of tuber cultivation using spatially offset Raman spectroscopy
1
2020
... 拉曼光谱结合化学计量学方法能对植物品种进行分类.Morey等[37]用9个土豆品种进行实验,由于土豆的颜色不同,散射光谱的强度也不同,将原始光谱标准化到1460 cm-1并用于之后的分析,用SORS技术实现了对土豆的营养成分分析、品种鉴定和产地确定.Farber等[38]基于正交偏最小二乘法法和籽粒的拉曼光谱实现95%的基因型区分准确度.研究还发现拉曼光谱可以用于检测花生籽粒的营养含量(碳水化合物、蛋白质、纤维、油、不饱和脂肪酸),说明拉曼光谱可以根据花生叶子和种子的光谱特征准确识别花生品种,用于精准育种.Jentzsch等[39]对从不同省份采集的National和CCN-51品种的可可豆样品进行研究,每个可可豆在4个不同的样品点测量,使用化学计量学处理光谱数据,区分品种总准确度为91.8%.同样地,拉曼光谱可以确定6种不同的玉米以及它们各自的营养成分[40]. ...
Raman spectroscopy enables non-invasive identification of peanut genotypes and value-added traits
1
2020
... 拉曼光谱结合化学计量学方法能对植物品种进行分类.Morey等[37]用9个土豆品种进行实验,由于土豆的颜色不同,散射光谱的强度也不同,将原始光谱标准化到1460 cm-1并用于之后的分析,用SORS技术实现了对土豆的营养成分分析、品种鉴定和产地确定.Farber等[38]基于正交偏最小二乘法法和籽粒的拉曼光谱实现95%的基因型区分准确度.研究还发现拉曼光谱可以用于检测花生籽粒的营养含量(碳水化合物、蛋白质、纤维、油、不饱和脂肪酸),说明拉曼光谱可以根据花生叶子和种子的光谱特征准确识别花生品种,用于精准育种.Jentzsch等[39]对从不同省份采集的National和CCN-51品种的可可豆样品进行研究,每个可可豆在4个不同的样品点测量,使用化学计量学处理光谱数据,区分品种总准确度为91.8%.同样地,拉曼光谱可以确定6种不同的玉米以及它们各自的营养成分[40]. ...
Distinction of Ecuadorian varieties of fermented cocoa beans using Raman spectroscopy
1
2016
... 拉曼光谱结合化学计量学方法能对植物品种进行分类.Morey等[37]用9个土豆品种进行实验,由于土豆的颜色不同,散射光谱的强度也不同,将原始光谱标准化到1460 cm-1并用于之后的分析,用SORS技术实现了对土豆的营养成分分析、品种鉴定和产地确定.Farber等[38]基于正交偏最小二乘法法和籽粒的拉曼光谱实现95%的基因型区分准确度.研究还发现拉曼光谱可以用于检测花生籽粒的营养含量(碳水化合物、蛋白质、纤维、油、不饱和脂肪酸),说明拉曼光谱可以根据花生叶子和种子的光谱特征准确识别花生品种,用于精准育种.Jentzsch等[39]对从不同省份采集的National和CCN-51品种的可可豆样品进行研究,每个可可豆在4个不同的样品点测量,使用化学计量学处理光谱数据,区分品种总准确度为91.8%.同样地,拉曼光谱可以确定6种不同的玉米以及它们各自的营养成分[40]. ...
Rapid and noninvasive typing and assessment of nutrient content of maize kernels using a handheld Raman spectrometer
1
2019
... 拉曼光谱结合化学计量学方法能对植物品种进行分类.Morey等[37]用9个土豆品种进行实验,由于土豆的颜色不同,散射光谱的强度也不同,将原始光谱标准化到1460 cm-1并用于之后的分析,用SORS技术实现了对土豆的营养成分分析、品种鉴定和产地确定.Farber等[38]基于正交偏最小二乘法法和籽粒的拉曼光谱实现95%的基因型区分准确度.研究还发现拉曼光谱可以用于检测花生籽粒的营养含量(碳水化合物、蛋白质、纤维、油、不饱和脂肪酸),说明拉曼光谱可以根据花生叶子和种子的光谱特征准确识别花生品种,用于精准育种.Jentzsch等[39]对从不同省份采集的National和CCN-51品种的可可豆样品进行研究,每个可可豆在4个不同的样品点测量,使用化学计量学处理光谱数据,区分品种总准确度为91.8%.同样地,拉曼光谱可以确定6种不同的玉米以及它们各自的营养成分[40]. ...
利用表面增强拉曼光谱定量检测植物激素脱落酸
1
2022
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Quantitative determination of plant hormone abscisic acid using surface enhanced Raman spectroscopy
1
2022
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Potential of NIR-FT-Raman spectroscopy in natural carotenoid analysis
1
2005
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Detection of pesticide residues using Nano-SERS chip and a smartphone-based Raman sensor
1
2018
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Applications of FT Raman spectroscopy and micro spectroscopy characterizing cellulose and cellulosic biomaterials
1
2005
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Structural analysis of lignin by resonance Raman spectroscopy
1
2005
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Lignin plays a key role in determining biomass recalcitrance in forage grasses
1
2020
... 拉曼光谱能够对植物中所含有的生物大分子物质进行表征.张燕燕等[41]基于SERS技术检测了植物激素脱落酸,检测限达到0.1 µmol/L,该方法结果与酶联免疫吸附剂测定(Enzyme Linked Immunosorbent Assay,ELISA)具有良好的吻合度.类胡萝卜素作为植物的重要色素,引起了研究者们的广泛研究.Schulz等[42]研究了近红外傅里叶变换拉曼光谱类胡萝卜素原位研究中的独特优势.从多种植物组织中获得的光谱表明,C=C伸缩振动的波数位置主要受类胡萝卜素多烯链的长度和末端取代基以及它们与其他植物成分的相互作用的影响.拉曼光谱可以用于在单细胞和多细胞层面对细胞壁中多糖进行成像分析,包括纤维素、半纤维素、果胶等物质,从而用于研究水果收获后存放过程中的软化机理,揭示在不同存放温度下果肉软化过程中的细胞壁成分分解过程[43].木质素纤维生物质可以作为可再生能源,富含可与木质素共价键结合的多糖,拉曼光谱在植物木质素的研究中也有探索[44,45].Oliveira等[46]用傅里叶变换红外光谱和拉曼光谱表征植物细胞壁,发现Coastcross和Tifton 85两种草在酶法水解后有更低的木质素颔联和更高的糖化,因此,拉曼光谱可以作为检测不同草品种中木质素含量的重要手段. ...
Early diagnosis and management of nitrogen deficiency in plants utilizing Raman spectroscopy
1
2020
... 拉曼光谱可以测量非生物胁迫.实时监测植物营养状态能够及时控制肥料的使用,提升产量和降低环境影响.Huang等[47]对拟南芥、小白菜和菜心三种作物进行氮素监测,发现1046 cm-1峰可以表征植物中的氮素状态,可用于对缺氮植物在没有任何可见症状前进行早期诊断氮素缺失.Sanchez等[48]使用便携式拉曼光谱仪实现了水稻氮、磷、钾的缺失症状的诊断,同时,他们还发现拉曼光谱可用于中高盐胁迫症状的预诊断.便携式夹叶传感器能够用于检测植物受到的氮素缺失和干旱胁迫,Gupta等[49]证明其监测结果和实验室台式拉曼光谱仪测量的结果一致,为拉曼光谱用于植物早期疾病现场诊断和监测植物胁迫状态提供了新工具.Zhao等[50]用共聚焦拉曼光谱扫描健康、早期缺锌和缺锌的水稻叶片,发现缺锌导致叶片中类胡萝卜素含量上升,其他成分如淀粉、蛋白质、糖类、氨基酸下降,结合最小二乘支持向量机模型建模分析,对三种叶片样品实现100%区分. ...
Raman spectroscopy enables non-invasive and confirmatory diagnostics of salinity stresses, nitrogen, phosphorus, and potassium deficiencies in rice
1
2020
... 拉曼光谱可以测量非生物胁迫.实时监测植物营养状态能够及时控制肥料的使用,提升产量和降低环境影响.Huang等[47]对拟南芥、小白菜和菜心三种作物进行氮素监测,发现1046 cm-1峰可以表征植物中的氮素状态,可用于对缺氮植物在没有任何可见症状前进行早期诊断氮素缺失.Sanchez等[48]使用便携式拉曼光谱仪实现了水稻氮、磷、钾的缺失症状的诊断,同时,他们还发现拉曼光谱可用于中高盐胁迫症状的预诊断.便携式夹叶传感器能够用于检测植物受到的氮素缺失和干旱胁迫,Gupta等[49]证明其监测结果和实验室台式拉曼光谱仪测量的结果一致,为拉曼光谱用于植物早期疾病现场诊断和监测植物胁迫状态提供了新工具.Zhao等[50]用共聚焦拉曼光谱扫描健康、早期缺锌和缺锌的水稻叶片,发现缺锌导致叶片中类胡萝卜素含量上升,其他成分如淀粉、蛋白质、糖类、氨基酸下降,结合最小二乘支持向量机模型建模分析,对三种叶片样品实现100%区分. ...
Portable Raman leaf-clip sensor for rapid detection of plant stress
1
2020
... 拉曼光谱可以测量非生物胁迫.实时监测植物营养状态能够及时控制肥料的使用,提升产量和降低环境影响.Huang等[47]对拟南芥、小白菜和菜心三种作物进行氮素监测,发现1046 cm-1峰可以表征植物中的氮素状态,可用于对缺氮植物在没有任何可见症状前进行早期诊断氮素缺失.Sanchez等[48]使用便携式拉曼光谱仪实现了水稻氮、磷、钾的缺失症状的诊断,同时,他们还发现拉曼光谱可用于中高盐胁迫症状的预诊断.便携式夹叶传感器能够用于检测植物受到的氮素缺失和干旱胁迫,Gupta等[49]证明其监测结果和实验室台式拉曼光谱仪测量的结果一致,为拉曼光谱用于植物早期疾病现场诊断和监测植物胁迫状态提供了新工具.Zhao等[50]用共聚焦拉曼光谱扫描健康、早期缺锌和缺锌的水稻叶片,发现缺锌导致叶片中类胡萝卜素含量上升,其他成分如淀粉、蛋白质、糖类、氨基酸下降,结合最小二乘支持向量机模型建模分析,对三种叶片样品实现100%区分. ...
Early detection of zinc deficit with confocal Raman spectroscopy
1
2018
... 拉曼光谱可以测量非生物胁迫.实时监测植物营养状态能够及时控制肥料的使用,提升产量和降低环境影响.Huang等[47]对拟南芥、小白菜和菜心三种作物进行氮素监测,发现1046 cm-1峰可以表征植物中的氮素状态,可用于对缺氮植物在没有任何可见症状前进行早期诊断氮素缺失.Sanchez等[48]使用便携式拉曼光谱仪实现了水稻氮、磷、钾的缺失症状的诊断,同时,他们还发现拉曼光谱可用于中高盐胁迫症状的预诊断.便携式夹叶传感器能够用于检测植物受到的氮素缺失和干旱胁迫,Gupta等[49]证明其监测结果和实验室台式拉曼光谱仪测量的结果一致,为拉曼光谱用于植物早期疾病现场诊断和监测植物胁迫状态提供了新工具.Zhao等[50]用共聚焦拉曼光谱扫描健康、早期缺锌和缺锌的水稻叶片,发现缺锌导致叶片中类胡萝卜素含量上升,其他成分如淀粉、蛋白质、糖类、氨基酸下降,结合最小二乘支持向量机模型建模分析,对三种叶片样品实现100%区分. ...
Noninvasive and nondestructive detection of cowpea bruchid within cowpea seeds with a hand-held Raman spectrometer
1
2019
... 拉曼光谱不仅用于非生物胁迫,在生物胁迫方面,它也能够在早期发现胁迫导致的植物生理状态的改变.Sanchez等[51]使用拉曼光谱观察到了来自豇豆绿豆象幼虫及其排泄物影响的光谱的变化,表明化学计量学与拉曼光谱相结合能够较准确地区分未受侵染的种子和受侵染的种子.该团队还用便携式拉曼光谱对番茄上Liberibacter疾病的非侵入性诊断,达到80%的准确率[52]. ...
Non-invasive diagnostics of Liberibacter disease on tomatoes using a hand-held Raman spectrometer
1
2020
... 拉曼光谱不仅用于非生物胁迫,在生物胁迫方面,它也能够在早期发现胁迫导致的植物生理状态的改变.Sanchez等[51]使用拉曼光谱观察到了来自豇豆绿豆象幼虫及其排泄物影响的光谱的变化,表明化学计量学与拉曼光谱相结合能够较准确地区分未受侵染的种子和受侵染的种子.该团队还用便携式拉曼光谱对番茄上Liberibacter疾病的非侵入性诊断,达到80%的准确率[52]. ...
Raman spectroscopy vs quantitative polymerase chain reaction in early stage Huanglongbing diagnostics
1
2020
... 在植物病原体诊断领域传统的“黄金标准”是定量聚合酶链反应(quantitative Polymerase Chain Reaction,qPCR)技术.Sanchez等[53]对拉曼光谱表征植物遭受病害的有效性进行了验证.通过利用qPCR技术对柑橘树的黄龙病进行早期对比诊断,发现拉曼光谱不仅能够预测早期黄龙病感染,还发现光谱中表现出了qPCR阴性植物的黄龙病特异光谱特征,可以与不相关的营养缺乏的植物区分开.因此,拉曼光谱对于黄龙病的诊断更加敏感.Lin等[54]也使用SERS检测了香蕉枯萎病的致病菌和感染枯萎病的香蕉假茎,实现无症状感染样品76.2%的检出率,和逆转录-聚合酶链反应技术检测效果相似.代芬等[55]基于自荧光光谱、拉曼光谱和混合光谱三种光谱的PLS-DA模型鉴别柑橘健康样本和黄龙病样本的准确率分别为86.08%、98.17%和94.75%,拉曼光谱模型的鉴别效果最优. ...
Construction of Raman spectroscopic fingerprints for the detection of Fusarium wilt of banana in Taiwan
1
2020
... 在植物病原体诊断领域传统的“黄金标准”是定量聚合酶链反应(quantitative Polymerase Chain Reaction,qPCR)技术.Sanchez等[53]对拉曼光谱表征植物遭受病害的有效性进行了验证.通过利用qPCR技术对柑橘树的黄龙病进行早期对比诊断,发现拉曼光谱不仅能够预测早期黄龙病感染,还发现光谱中表现出了qPCR阴性植物的黄龙病特异光谱特征,可以与不相关的营养缺乏的植物区分开.因此,拉曼光谱对于黄龙病的诊断更加敏感.Lin等[54]也使用SERS检测了香蕉枯萎病的致病菌和感染枯萎病的香蕉假茎,实现无症状感染样品76.2%的检出率,和逆转录-聚合酶链反应技术检测效果相似.代芬等[55]基于自荧光光谱、拉曼光谱和混合光谱三种光谱的PLS-DA模型鉴别柑橘健康样本和黄龙病样本的准确率分别为86.08%、98.17%和94.75%,拉曼光谱模型的鉴别效果最优. ...
基于拉曼光谱和自荧光光谱的柑橘黄龙病快速检测方法
1
2019
... 在植物病原体诊断领域传统的“黄金标准”是定量聚合酶链反应(quantitative Polymerase Chain Reaction,qPCR)技术.Sanchez等[53]对拉曼光谱表征植物遭受病害的有效性进行了验证.通过利用qPCR技术对柑橘树的黄龙病进行早期对比诊断,发现拉曼光谱不仅能够预测早期黄龙病感染,还发现光谱中表现出了qPCR阴性植物的黄龙病特异光谱特征,可以与不相关的营养缺乏的植物区分开.因此,拉曼光谱对于黄龙病的诊断更加敏感.Lin等[54]也使用SERS检测了香蕉枯萎病的致病菌和感染枯萎病的香蕉假茎,实现无症状感染样品76.2%的检出率,和逆转录-聚合酶链反应技术检测效果相似.代芬等[55]基于自荧光光谱、拉曼光谱和混合光谱三种光谱的PLS-DA模型鉴别柑橘健康样本和黄龙病样本的准确率分别为86.08%、98.17%和94.75%,拉曼光谱模型的鉴别效果最优. ...
Rapid detection of citrus Huanglongbing using Raman spectroscopy and Auto-fluorescence spectroscopy
1
2019
... 在植物病原体诊断领域传统的“黄金标准”是定量聚合酶链反应(quantitative Polymerase Chain Reaction,qPCR)技术.Sanchez等[53]对拉曼光谱表征植物遭受病害的有效性进行了验证.通过利用qPCR技术对柑橘树的黄龙病进行早期对比诊断,发现拉曼光谱不仅能够预测早期黄龙病感染,还发现光谱中表现出了qPCR阴性植物的黄龙病特异光谱特征,可以与不相关的营养缺乏的植物区分开.因此,拉曼光谱对于黄龙病的诊断更加敏感.Lin等[54]也使用SERS检测了香蕉枯萎病的致病菌和感染枯萎病的香蕉假茎,实现无症状感染样品76.2%的检出率,和逆转录-聚合酶链反应技术检测效果相似.代芬等[55]基于自荧光光谱、拉曼光谱和混合光谱三种光谱的PLS-DA模型鉴别柑橘健康样本和黄龙病样本的准确率分别为86.08%、98.17%和94.75%,拉曼光谱模型的鉴别效果最优. ...
Raman spectroscopy for the control of soil contamination by copper ions
1
2015
... 拉曼光谱在植物重金属胁迫和纳米离子污染胁迫中也有研究.Timchenko等[56]基于拉曼光谱成功研究了土壤中的铜离子浓度变化对于植物光学特性的影响. ...
Small and sharp triangular silver nanoplates synthesized utilizing tiny triangular nuclei and their excellent SERS activity for selective detection of thiram residue in soil
1
2017
... 拉曼光谱可以用于土壤中农药的残留检测.Zhang等[57]首次提出用SERS检测土壤中的福美双(Thiram),但需要离心提取样品,添加剂诱导福美双在纳米颗粒(NPs)上吸附,实验过程复杂繁琐,不利于快速、简便地分析.为了在复杂的基体中进行现场测量,Lin等[58]研发了一种基于纸基分离技术的表面增强拉曼光谱基底用于测量土壤中的福美双.这种纸基传感器可以获得0.56×105的增强因子,在点到点的拉曼强度变化低至12.8%,具有出色的重复性,不用任何预处理可以实现土壤中福美双的定量检测. ...
Lab-on-paper surface-enhanced Raman spectroscopy platform based on self-assembled Au@ Ag nanocube monolayer for on-site detection of thiram in soil
1
2019
... 拉曼光谱可以用于土壤中农药的残留检测.Zhang等[57]首次提出用SERS检测土壤中的福美双(Thiram),但需要离心提取样品,添加剂诱导福美双在纳米颗粒(NPs)上吸附,实验过程复杂繁琐,不利于快速、简便地分析.为了在复杂的基体中进行现场测量,Lin等[58]研发了一种基于纸基分离技术的表面增强拉曼光谱基底用于测量土壤中的福美双.这种纸基传感器可以获得0.56×105的增强因子,在点到点的拉曼强度变化低至12.8%,具有出色的重复性,不用任何预处理可以实现土壤中福美双的定量检测. ...
Quantitative determination of thiabendazole in soil extracts by surface-enhanced Raman spectroscopy
1
2018
... 拉曼光谱对噻菌灵(Thiabendazole)、扑草净(Prometryn)、阿特拉津(Atrazine)[59,60]等不同种类的农药检测也同样有效.这些研究说明拉曼光谱可以用于土壤中农药残留的检测. ...
Increasing the sensitivity of surface‐enhanced Raman scattering detection for s‐triazine pesticides by taking advantage of interactions with soil humic substances
1
2022
... 拉曼光谱对噻菌灵(Thiabendazole)、扑草净(Prometryn)、阿特拉津(Atrazine)[59,60]等不同种类的农药检测也同样有效.这些研究说明拉曼光谱可以用于土壤中农药残留的检测. ...
D2O-isotope-labeling approach to probing phosphate-solubilizing bacteria in complex soil communities by single-cell Raman spectroscopy
1
2019
... 拉曼光谱可以用于检测土壤中的菌落.生物固氮是将惰性氮气(N2)转化为生物可利用氮(氨或硝酸盐)的关键过程.D2O同位素标记的单细胞拉曼光谱可以用于检测土壤中的溶磷菌,并且可以将C-D带的强度在C-H和C-D带的比例作为磷释放量的半定量生物指标[61].Schwarz等[62]介绍了一种使用聚乙烯亚胺(PEI)改性聚乙烯颗粒从复杂土壤样品中分离各种细菌的快速简单的策略,从土壤中分离出来的大肠杆菌、枯草芽孢杆菌、荧光假单胞菌、链霉菌和酸链霉菌等可以用拉曼光谱结合化学计量学方法达到92%的识别率. ...
Pioneering particle-based strategy for isolating viable bacteria from multipart soil samples compatible with Raman spectroscopy
1
2017
... 拉曼光谱可以用于检测土壤中的菌落.生物固氮是将惰性氮气(N2)转化为生物可利用氮(氨或硝酸盐)的关键过程.D2O同位素标记的单细胞拉曼光谱可以用于检测土壤中的溶磷菌,并且可以将C-D带的强度在C-H和C-D带的比例作为磷释放量的半定量生物指标[61].Schwarz等[62]介绍了一种使用聚乙烯亚胺(PEI)改性聚乙烯颗粒从复杂土壤样品中分离各种细菌的快速简单的策略,从土壤中分离出来的大肠杆菌、枯草芽孢杆菌、荧光假单胞菌、链霉菌和酸链霉菌等可以用拉曼光谱结合化学计量学方法达到92%的识别率. ...
Rapid and quantitative determination of soil water-soluble nitrogen based on surface-enhanced Raman spectroscopy analysis
1
2018
... 拉曼光谱可以用于检测土壤中的水溶性氮.准确和快速测定土壤中的水溶性氮对于科学施肥有很大帮助.Dong等[63]使用SERS和Opto Trace Raman 202(OTR202)基底实现对土壤中水溶性氮的定量检测.研究发现,所用SERS基底的增强效应要强于金纳米基底和银纳米基底.用PLS对一次微分处理过的原始光谱进行建模所获得的预测准确度最高(Rp2 = 0.91,RMSEp = 8.76 mg/L,RPD = 3.00).1028、1370、1436和1636 cm-1都是水溶性氮的特征峰,其中1370 cm-1特征峰的强度和水溶性氮浓度的关联最高(Rp2=0.94).基于PCA和最小二乘支持向量机(Least Squares Supports Vector Machine,LS-SVM)对高水溶性氮含量(70.5~118.3 mg/L)和低水溶性氮含量(22.7~63.7 mg/L)的土壤可以达到86.67%的区分,有助于科学精准施肥.磷是生命体新陈代谢的必需元素.Vogel等[64]在2013年用可见光拉曼显微法测定土壤中的磷相态,但由于土壤中其他有机物质的荧光太强没有分析土壤中的磷酸盐相态,在之后实验中用深紫外激光进行激发,避免了荧光的干扰[65]. ...
Determination of phosphate phases in sewage sludge ash-based fertilizers by Raman microspectroscopy
1
2013
... 拉曼光谱可以用于检测土壤中的水溶性氮.准确和快速测定土壤中的水溶性氮对于科学施肥有很大帮助.Dong等[63]使用SERS和Opto Trace Raman 202(OTR202)基底实现对土壤中水溶性氮的定量检测.研究发现,所用SERS基底的增强效应要强于金纳米基底和银纳米基底.用PLS对一次微分处理过的原始光谱进行建模所获得的预测准确度最高(Rp2 = 0.91,RMSEp = 8.76 mg/L,RPD = 3.00).1028、1370、1436和1636 cm-1都是水溶性氮的特征峰,其中1370 cm-1特征峰的强度和水溶性氮浓度的关联最高(Rp2=0.94).基于PCA和最小二乘支持向量机(Least Squares Supports Vector Machine,LS-SVM)对高水溶性氮含量(70.5~118.3 mg/L)和低水溶性氮含量(22.7~63.7 mg/L)的土壤可以达到86.67%的区分,有助于科学精准施肥.磷是生命体新陈代谢的必需元素.Vogel等[64]在2013年用可见光拉曼显微法测定土壤中的磷相态,但由于土壤中其他有机物质的荧光太强没有分析土壤中的磷酸盐相态,在之后实验中用深紫外激光进行激发,避免了荧光的干扰[65]. ...
Microspectroscopy–promising techniques to characterize phosphorus in soil
1
2016
... 拉曼光谱可以用于检测土壤中的水溶性氮.准确和快速测定土壤中的水溶性氮对于科学施肥有很大帮助.Dong等[63]使用SERS和Opto Trace Raman 202(OTR202)基底实现对土壤中水溶性氮的定量检测.研究发现,所用SERS基底的增强效应要强于金纳米基底和银纳米基底.用PLS对一次微分处理过的原始光谱进行建模所获得的预测准确度最高(Rp2 = 0.91,RMSEp = 8.76 mg/L,RPD = 3.00).1028、1370、1436和1636 cm-1都是水溶性氮的特征峰,其中1370 cm-1特征峰的强度和水溶性氮浓度的关联最高(Rp2=0.94).基于PCA和最小二乘支持向量机(Least Squares Supports Vector Machine,LS-SVM)对高水溶性氮含量(70.5~118.3 mg/L)和低水溶性氮含量(22.7~63.7 mg/L)的土壤可以达到86.67%的区分,有助于科学精准施肥.磷是生命体新陈代谢的必需元素.Vogel等[64]在2013年用可见光拉曼显微法测定土壤中的磷相态,但由于土壤中其他有机物质的荧光太强没有分析土壤中的磷酸盐相态,在之后实验中用深紫外激光进行激发,避免了荧光的干扰[65]. ...
Determination of copper, zinc, cadmium and lead in water using co-precipitation method and Raman spectroscopy
1
2013
... 在水中重金属和化学污染物检测方面,Liu等[66]采用锰共沉淀法结合拉曼光谱法测定微量重金属(铜、锌、镉、铅),采用偏最小二乘回归模型建立的铜、锌、镉、铅的预测的相关系数可分别达到0.979、0.964、0.956和0.972,均方根误差分别为6.587、9.046、9.998和7.751 μg/kg,表明采用共沉淀法结合拉曼光谱法测定水中重金属含量是可行的.金属有机框架材料(Metal-Organic Frameworks,MOF)具有可调的多孔结构和出色的吸附能力,通过调节等离激元MOF的孔尺寸,可以有效地产生筛选效应,降低其他生物样品的干扰.Hu等[67]用在MIL-101里面嵌入金纳米颗粒制作的新型SERS底物实现环境水中对苯二胺(p-phenylenediamine)的定量分析,在1~100 ng/mL之间的相关系数达到0.995. ...
Fabrication of gold nanoparticle-embedded metal-organic framework for highly sensitive surface-enhanced Raman scattering detection
1
2014
... 在水中重金属和化学污染物检测方面,Liu等[66]采用锰共沉淀法结合拉曼光谱法测定微量重金属(铜、锌、镉、铅),采用偏最小二乘回归模型建立的铜、锌、镉、铅的预测的相关系数可分别达到0.979、0.964、0.956和0.972,均方根误差分别为6.587、9.046、9.998和7.751 μg/kg,表明采用共沉淀法结合拉曼光谱法测定水中重金属含量是可行的.金属有机框架材料(Metal-Organic Frameworks,MOF)具有可调的多孔结构和出色的吸附能力,通过调节等离激元MOF的孔尺寸,可以有效地产生筛选效应,降低其他生物样品的干扰.Hu等[67]用在MIL-101里面嵌入金纳米颗粒制作的新型SERS底物实现环境水中对苯二胺(p-phenylenediamine)的定量分析,在1~100 ng/mL之间的相关系数达到0.995. ...
Microporous plasmonic capsules as stable molecular sieves for direct SERS quantification of small pollutants in natural waters
1
2019
... 对于水的农药残留检测也有研究.直接用SERS检测自然污染的水存在非特异性共吸附问题,即水中的其他物质和待测物非特异性共吸附到金属纳米结构上.为克服这一问题,Mariño-Lopez等[68]用内部含有金纳米颗粒的微孔二氧化硅胶囊作为SERS底物进行检测,这种微孔结构能够作为分子筛阻止大生物分子和细胞到达等离激元部分,并且能够使溶胶更稳定,使得滴滴涕(Dichlorodiphenyltrichloroethane)的检测限可达到1.77 μg/L. ...
Raman spectroscopy and chemical imaging for quantification of filtered waterborne bacteria
1
2006
... 拉曼光谱也可以用于水中细菌的检测.Escoriza等[69]评估了拉曼光谱作为水传播病原体计数技术的适用性,选择了2800~3000 cm-1之间观察到的显著的C-H伸缩带用于光谱量化目的.通过过滤浓缩的样品显示出了拉曼光谱与其他定量方法之间的良好相关性,包括浊度(R2=0.92)、平板计数(R2=0.87)和干重(R2=0.97). ...
Study on the application of Raman spectroscopy on detecting water hardness
1
2014
... 拉曼光谱对于水的物理特性检测也有相关研究.Yang等[70]采用拉曼光谱法对四种水样的硬度指标进行了研究.结果表明,随着水的总硬度的降低,水的弯曲振动强度与拉伸振动强度之比减小.这说明拉曼光谱可以直接测量水的总硬度,为水质分析提供了一种简单有效的方法.由于拉曼光谱用于水质检测存在优势,这一课题引起了研究者广泛关注.Li等[71,72]对于拉曼光谱用于水质检测进行了总结和归纳,根据污染物的类型介绍了用于水质检测的各种拉曼光谱技术,总结了各种拉曼光谱技术的优点和局限性.拉曼光谱也可用于水温度检测[73,74]. ...
Applications of Raman spectroscopy in detection of water quality
1
2016
... 拉曼光谱对于水的物理特性检测也有相关研究.Yang等[70]采用拉曼光谱法对四种水样的硬度指标进行了研究.结果表明,随着水的总硬度的降低,水的弯曲振动强度与拉伸振动强度之比减小.这说明拉曼光谱可以直接测量水的总硬度,为水质分析提供了一种简单有效的方法.由于拉曼光谱用于水质检测存在优势,这一课题引起了研究者广泛关注.Li等[71,72]对于拉曼光谱用于水质检测进行了总结和归纳,根据污染物的类型介绍了用于水质检测的各种拉曼光谱技术,总结了各种拉曼光谱技术的优点和局限性.拉曼光谱也可用于水温度检测[73,74]. ...
Raman spectroscopy for in-line water quality monitoring—Instrumentation and potential
1
2014
... 拉曼光谱对于水的物理特性检测也有相关研究.Yang等[70]采用拉曼光谱法对四种水样的硬度指标进行了研究.结果表明,随着水的总硬度的降低,水的弯曲振动强度与拉伸振动强度之比减小.这说明拉曼光谱可以直接测量水的总硬度,为水质分析提供了一种简单有效的方法.由于拉曼光谱用于水质检测存在优势,这一课题引起了研究者广泛关注.Li等[71,72]对于拉曼光谱用于水质检测进行了总结和归纳,根据污染物的类型介绍了用于水质检测的各种拉曼光谱技术,总结了各种拉曼光谱技术的优点和局限性.拉曼光谱也可用于水温度检测[73,74]. ...
Study on practical Raman Lidar seawater temperature remote sensing system
2
39
... 拉曼光谱对于水的物理特性检测也有相关研究.Yang等[70]采用拉曼光谱法对四种水样的硬度指标进行了研究.结果表明,随着水的总硬度的降低,水的弯曲振动强度与拉伸振动强度之比减小.这说明拉曼光谱可以直接测量水的总硬度,为水质分析提供了一种简单有效的方法.由于拉曼光谱用于水质检测存在优势,这一课题引起了研究者广泛关注.Li等[71,72]对于拉曼光谱用于水质检测进行了总结和归纳,根据污染物的类型介绍了用于水质检测的各种拉曼光谱技术,总结了各种拉曼光谱技术的优点和局限性.拉曼光谱也可用于水温度检测[73,74]. ...
... 农业领域检测场景复杂多样,因此需要不同测量方式的拉曼光谱仪以满足实验室和现场的测量需求.便携式拉曼光谱仪可在现场用于植物的原位和在线测量,更加稳定和准确的便携拉曼光谱测量方法需要进一步研究.遥测拉曼光谱仪的测量已经有关于水温测量的研究[73,74],但至今还没有用于农业其他方面的研究,需要进一步研究和分析.未来甚至可以将主动光源激发的拉曼光谱仪装在无人机和农机设备上,从而实现地面和近地面的联动信息获取. ...
Remote sensing of subsurface water temperature by laser Raman spectroscopy
2
1980
... 拉曼光谱对于水的物理特性检测也有相关研究.Yang等[70]采用拉曼光谱法对四种水样的硬度指标进行了研究.结果表明,随着水的总硬度的降低,水的弯曲振动强度与拉伸振动强度之比减小.这说明拉曼光谱可以直接测量水的总硬度,为水质分析提供了一种简单有效的方法.由于拉曼光谱用于水质检测存在优势,这一课题引起了研究者广泛关注.Li等[71,72]对于拉曼光谱用于水质检测进行了总结和归纳,根据污染物的类型介绍了用于水质检测的各种拉曼光谱技术,总结了各种拉曼光谱技术的优点和局限性.拉曼光谱也可用于水温度检测[73,74]. ...
... 农业领域检测场景复杂多样,因此需要不同测量方式的拉曼光谱仪以满足实验室和现场的测量需求.便携式拉曼光谱仪可在现场用于植物的原位和在线测量,更加稳定和准确的便携拉曼光谱测量方法需要进一步研究.遥测拉曼光谱仪的测量已经有关于水温测量的研究[73,74],但至今还没有用于农业其他方面的研究,需要进一步研究和分析.未来甚至可以将主动光源激发的拉曼光谱仪装在无人机和农机设备上,从而实现地面和近地面的联动信息获取. ...
In situ detection of thiram in fruits and vegetables by colorimetry/surface-enhanced Raman spectroscopy
1
2020
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
Rapid nondestructive detection of mixed pesticides residues on fruit surface using SERS combined with self-modeling mixture analysis method
1
2020
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
Rapid detection of chlorpyrifos pesticide residue concentration in agro-product using Raman spectroscopy
1
2014
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
采用表面增强拉曼光谱技术快速检测脐橙果皮中抑霉唑残留
1
2021
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
Rapid detection of Imazalil residues in navel orange peel using surface-enhanced Raman spectroscopy
1
2021
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
Optical screening methods for pesticide residue detection in food matrices: Advances and emerging analytical trends
1
2021
... 果蔬上的农药残留严重威胁人类的健康安全,拉曼光谱可以用于检测果蔬中的农药残留.聚乙烯醇修饰的金纳米颗粒溶胶用于检测水果和蔬菜中的福美双残留,将溶胶滴在被测量样品表面,在苹果、梨和蔬菜中检测限可以分别达到4.62、7.83、10.74 μg/L,远低于5 μg/mL的国家标准,同时可以使用比色法人眼观察是否有福美双残留,通过SERS技术进一步验证,在实际应用中具有重要的意义[75].拉曼光谱不仅可以用于单一农药的测量,还可以更加适应实际情况,检测混合农药,减少农药对人体的伤害,Hu等[76]提出一个无损伤和灵敏的方法,用SERS加界面自组装金纳米棒阵列衬底来测量基于拭子提取法回收的果实表面的福美双和噻菌灵的混合物残留,使用自建模混合分析(Self-Modeling Mixture Analysis,SMA)方法可以同时实现两个单成分的定性和定量分析,在苹果、番茄、梨上检测限针对福美双分别达到0.041、0.029、0.047 ng/cm2,对于噻菌灵分别达到0.79、0.76、0.80 ng/cm2,表明SERS检测结合SMA方法能够在实际应用中提供多分析物检测.Dhakal等使用拉曼光谱检测苹果上的毒死蜱,将677 cm-1的拉曼特征峰认定为毒死蜱的指纹光谱,峰强度与使用气相色谱法获得的实际农药浓度相关,并建立了多元线性回归(Multiple Linear Regression,MLR)预测模型,校准和验证的相关系数分别为0.86和0.81[77].食品上的农药残留由于对人体健康造成的巨大潜在威胁而引起了研究者们的广泛关注.张莎等[78]使用SERS技术检测脐橙果肉中的抑霉唑残留,结合PCA和支持向量回归(Support Vector Regression,SVR)算法的预测集Rp可高达0.9156;Tsagkaris等[79]汇总了2016—2020年的基于光学检测的农药残留筛查方法,包括了自发拉曼光谱和表面增强拉曼光谱技术等. ...
Rapid detection of tetracycline residues in duck meat using surface enhanced Raman spectroscopy
1
2016
... 肉类食品中的药物等非食品添加剂也严重影响和威胁人类的身体健康.Zhao等[80]基于表面增强拉曼光谱测量鸭肉中四环素残留,使用1272和1558 cm-1拉曼峰强的比值建立校准曲线,和鸭肉中提取物中的线性回归方程的相关系数为0.950,相对标准偏差可以达到2.4%~2.6%,结果表明这是一种快速检测鸭肉中四环素残留的良好检测方案.Girmatsion等[81]总结了在牛奶和肉制品(包括鸡肉、鸭肉、鱼和猪肉)中药物分析的表面增强拉曼光谱方法和应用. ...
Rapid detection of antibiotic residues in animal products using surface-enhanced Raman Spectroscopy: A review
1
2021
... 肉类食品中的药物等非食品添加剂也严重影响和威胁人类的身体健康.Zhao等[80]基于表面增强拉曼光谱测量鸭肉中四环素残留,使用1272和1558 cm-1拉曼峰强的比值建立校准曲线,和鸭肉中提取物中的线性回归方程的相关系数为0.950,相对标准偏差可以达到2.4%~2.6%,结果表明这是一种快速检测鸭肉中四环素残留的良好检测方案.Girmatsion等[81]总结了在牛奶和肉制品(包括鸡肉、鸭肉、鱼和猪肉)中药物分析的表面增强拉曼光谱方法和应用. ...
Raman spectral analysis for non-invasive detection of external and internal parameters of fake eggs
1
2020
... 在经济效益的推动下,不法生产者在食品里面掺假以谋取不法利益.拉曼光谱用于食品掺假的研究已经广泛存在,Joshi等[82]使用1295 cm-1作为特征峰进行拉曼成像,对假鸡蛋的内外参数进行无侵入分析,并且结合算法可以实现真假鸡蛋的区分.Oroian等[83]基于拉曼光谱研究了掺入果糖、葡萄糖、转化糖、水解菊粉糖浆和麦芽汁的蜂蜜,结合PLS-DA算法对于正宗蜂蜜和掺假蜂蜜识别的总准确率可以达到96.54%.Xu等[84]对拉曼光谱用于食品掺假方面的研究进行了总结. ...
Honey adulteration detection using Raman spectroscopy
1
2018
... 在经济效益的推动下,不法生产者在食品里面掺假以谋取不法利益.拉曼光谱用于食品掺假的研究已经广泛存在,Joshi等[82]使用1295 cm-1作为特征峰进行拉曼成像,对假鸡蛋的内外参数进行无侵入分析,并且结合算法可以实现真假鸡蛋的区分.Oroian等[83]基于拉曼光谱研究了掺入果糖、葡萄糖、转化糖、水解菊粉糖浆和麦芽汁的蜂蜜,结合PLS-DA算法对于正宗蜂蜜和掺假蜂蜜识别的总准确率可以达到96.54%.Xu等[84]对拉曼光谱用于食品掺假方面的研究进行了总结. ...
Raman spectroscopy coupled with chemometrics for food authentication: A review
1
2020
... 在经济效益的推动下,不法生产者在食品里面掺假以谋取不法利益.拉曼光谱用于食品掺假的研究已经广泛存在,Joshi等[82]使用1295 cm-1作为特征峰进行拉曼成像,对假鸡蛋的内外参数进行无侵入分析,并且结合算法可以实现真假鸡蛋的区分.Oroian等[83]基于拉曼光谱研究了掺入果糖、葡萄糖、转化糖、水解菊粉糖浆和麦芽汁的蜂蜜,结合PLS-DA算法对于正宗蜂蜜和掺假蜂蜜识别的总准确率可以达到96.54%.Xu等[84]对拉曼光谱用于食品掺假方面的研究进行了总结. ...
Heating effects of desi ghee using Raman spectroscopy
1
2018
... 拉曼光谱可以用于检测食品品质,Ahmad等[85]利用拉曼光谱研究了温度对德西酥油分子组成的影响,结果发现,随着油温升高,560~770 cm-1、790~1160 cm-1和1180~1285 cm-1的拉曼峰发生变化.在500~1800 cm-1的拉曼光谱范围内,对于不同的烹饪温度,用PCA算法进行了分类分析.发现140~180 ℃是德西酥油的烹饪的安全温度,在此温度内不会造成分子组成改变和营养流失.在鱼肉的新鲜度方面,Velioğlu等[86]用拉曼光谱结合化学计量分析实现对6种不同鱼类的份鱼类样本的物种判别分析,并实现对新鲜、一次冻融和两次冻融程度的鱼肉进行区分.除了直接检测肉质成分从而判断食品是否变质外,还可以通过拉曼光谱检测到肉类的剪切力,从而进行肉类质量评估.Fowler等[87]用拉曼光谱预测了新鲜羊半膜嫩度,与粒度分析(Particle Size Analysis,PSA)测量相比,拉曼光谱可能是剪切力变化的更好指标. ...
Differentiation of fresh and frozen-thawed fish samples using Raman spectroscopy coupled with chemometric analysis
1
2015
... 拉曼光谱可以用于检测食品品质,Ahmad等[85]利用拉曼光谱研究了温度对德西酥油分子组成的影响,结果发现,随着油温升高,560~770 cm-1、790~1160 cm-1和1180~1285 cm-1的拉曼峰发生变化.在500~1800 cm-1的拉曼光谱范围内,对于不同的烹饪温度,用PCA算法进行了分类分析.发现140~180 ℃是德西酥油的烹饪的安全温度,在此温度内不会造成分子组成改变和营养流失.在鱼肉的新鲜度方面,Velioğlu等[86]用拉曼光谱结合化学计量分析实现对6种不同鱼类的份鱼类样本的物种判别分析,并实现对新鲜、一次冻融和两次冻融程度的鱼肉进行区分.除了直接检测肉质成分从而判断食品是否变质外,还可以通过拉曼光谱检测到肉类的剪切力,从而进行肉类质量评估.Fowler等[87]用拉曼光谱预测了新鲜羊半膜嫩度,与粒度分析(Particle Size Analysis,PSA)测量相比,拉曼光谱可能是剪切力变化的更好指标. ...
Predicting tenderness of fresh ovine semimembranosus using Raman spectroscopy
1
2014
... 拉曼光谱可以用于检测食品品质,Ahmad等[85]利用拉曼光谱研究了温度对德西酥油分子组成的影响,结果发现,随着油温升高,560~770 cm-1、790~1160 cm-1和1180~1285 cm-1的拉曼峰发生变化.在500~1800 cm-1的拉曼光谱范围内,对于不同的烹饪温度,用PCA算法进行了分类分析.发现140~180 ℃是德西酥油的烹饪的安全温度,在此温度内不会造成分子组成改变和营养流失.在鱼肉的新鲜度方面,Velioğlu等[86]用拉曼光谱结合化学计量分析实现对6种不同鱼类的份鱼类样本的物种判别分析,并实现对新鲜、一次冻融和两次冻融程度的鱼肉进行区分.除了直接检测肉质成分从而判断食品是否变质外,还可以通过拉曼光谱检测到肉类的剪切力,从而进行肉类质量评估.Fowler等[87]用拉曼光谱预测了新鲜羊半膜嫩度,与粒度分析(Particle Size Analysis,PSA)测量相比,拉曼光谱可能是剪切力变化的更好指标. ...
Discrimination of irradiated starch gels using FT-Raman spectroscopy and chemometrics
2
2006
... 农业领域检测对象大多是带有强荧光的物质.荧光信号限制了拉曼信号的分析,许多样品,尤其是生物样品,在可见光的激发下产生很强的荧光信号,甚至湮没拉曼信号.解决荧光信号干扰的问题也是拉曼光谱应用于农业检测面临的重要问题.降低拉曼光谱测量的荧光信号主要分两个方面:一个是测量系统改进,另一个是算法处理.在测量系统改进方面,近红外激发光激发样品能够有效减小样品产生的荧光,1064 nm作为激发光,使用铟镓砷探测器的拉曼系统,可以有效降低待测物质的荧光效应对拉曼测量的影响[88].除了改变激发光波长,移频激发拉曼差分光谱也能够有效消除测量过程中的荧光.Theurer等[89]使用785 nm附近的两个光源激发样品,通过差分处理,对土壤进行表征,有效降低了荧光信号.在算法方面,主要有airPLS等算法[90]和多项式拟合算法进行基线校正.拉曼光谱在农业领域应用的研究中,研发适用于农业对象(土壤、水质、植物、动物等)的专用拉曼设备,从而获得最佳的拉曼信号是发展方向. ...
... 拉曼光谱在农业领域需要更高的灵敏度进行目标物的识别、分析.超低浓度检测物的定量问题吸引了研究者的关注.SERS是超灵敏检测的一个很有潜力的工具,但是在超低浓度检测中,很强的信号起伏限制它成为一种定量技术.通过改进SERS增强基底,可以针对不同的检测物进行修饰,并且可以提高稳定性和灵敏度,增加重复利用次数,提高经济性,而且现在有非金属的SERS基底能够有很好的生物相容性[91],为SERS用于农业领域的研究拓宽思路.傅里叶拉曼光谱因为没有色散元件,同样能够比色散型拉曼光谱仪信号更强[88].共振拉曼光谱也是提升灵敏度的一种有效方法.未来的农业应用中,针对不同的研究环境和研究需求进行适合的技术选择甚至将不同技术的优势进行融合能够提供更高的灵敏度. ...
Shifted excitation Raman difference spectroscopy: A promising tool for the investigation of soil
1
2021
... 农业领域检测对象大多是带有强荧光的物质.荧光信号限制了拉曼信号的分析,许多样品,尤其是生物样品,在可见光的激发下产生很强的荧光信号,甚至湮没拉曼信号.解决荧光信号干扰的问题也是拉曼光谱应用于农业检测面临的重要问题.降低拉曼光谱测量的荧光信号主要分两个方面:一个是测量系统改进,另一个是算法处理.在测量系统改进方面,近红外激发光激发样品能够有效减小样品产生的荧光,1064 nm作为激发光,使用铟镓砷探测器的拉曼系统,可以有效降低待测物质的荧光效应对拉曼测量的影响[88].除了改变激发光波长,移频激发拉曼差分光谱也能够有效消除测量过程中的荧光.Theurer等[89]使用785 nm附近的两个光源激发样品,通过差分处理,对土壤进行表征,有效降低了荧光信号.在算法方面,主要有airPLS等算法[90]和多项式拟合算法进行基线校正.拉曼光谱在农业领域应用的研究中,研发适用于农业对象(土壤、水质、植物、动物等)的专用拉曼设备,从而获得最佳的拉曼信号是发展方向. ...
Baseline correction using adaptive iteratively reweighted penalized least squares
1
2010
... 农业领域检测对象大多是带有强荧光的物质.荧光信号限制了拉曼信号的分析,许多样品,尤其是生物样品,在可见光的激发下产生很强的荧光信号,甚至湮没拉曼信号.解决荧光信号干扰的问题也是拉曼光谱应用于农业检测面临的重要问题.降低拉曼光谱测量的荧光信号主要分两个方面:一个是测量系统改进,另一个是算法处理.在测量系统改进方面,近红外激发光激发样品能够有效减小样品产生的荧光,1064 nm作为激发光,使用铟镓砷探测器的拉曼系统,可以有效降低待测物质的荧光效应对拉曼测量的影响[88].除了改变激发光波长,移频激发拉曼差分光谱也能够有效消除测量过程中的荧光.Theurer等[89]使用785 nm附近的两个光源激发样品,通过差分处理,对土壤进行表征,有效降低了荧光信号.在算法方面,主要有airPLS等算法[90]和多项式拟合算法进行基线校正.拉曼光谱在农业领域应用的研究中,研发适用于农业对象(土壤、水质、植物、动物等)的专用拉曼设备,从而获得最佳的拉曼信号是发展方向. ...
Porous carbon nanowire array for surface-enhanced Raman spectroscopy
1
2020
... 拉曼光谱在农业领域需要更高的灵敏度进行目标物的识别、分析.超低浓度检测物的定量问题吸引了研究者的关注.SERS是超灵敏检测的一个很有潜力的工具,但是在超低浓度检测中,很强的信号起伏限制它成为一种定量技术.通过改进SERS增强基底,可以针对不同的检测物进行修饰,并且可以提高稳定性和灵敏度,增加重复利用次数,提高经济性,而且现在有非金属的SERS基底能够有很好的生物相容性[91],为SERS用于农业领域的研究拓宽思路.傅里叶拉曼光谱因为没有色散元件,同样能够比色散型拉曼光谱仪信号更强[88].共振拉曼光谱也是提升灵敏度的一种有效方法.未来的农业应用中,针对不同的研究环境和研究需求进行适合的技术选择甚至将不同技术的优势进行融合能够提供更高的灵敏度. ...
Application of PLSR in rapid detection of glucose in sheep serum
1
2020
... 在动物科学领域,结合拉曼光谱和化学计量学方法能够在体监测动物的生理化学状况,从而推断动物的健康状况.但是对于活体动物中的监测的理化指标较少,现有典型的监测指标为葡萄糖[92],需要有更多的研究来用于活体动物理化指标的监测. ...