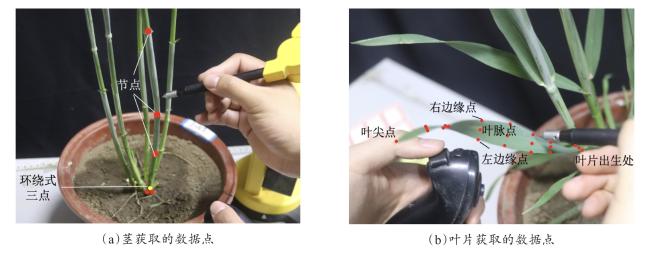
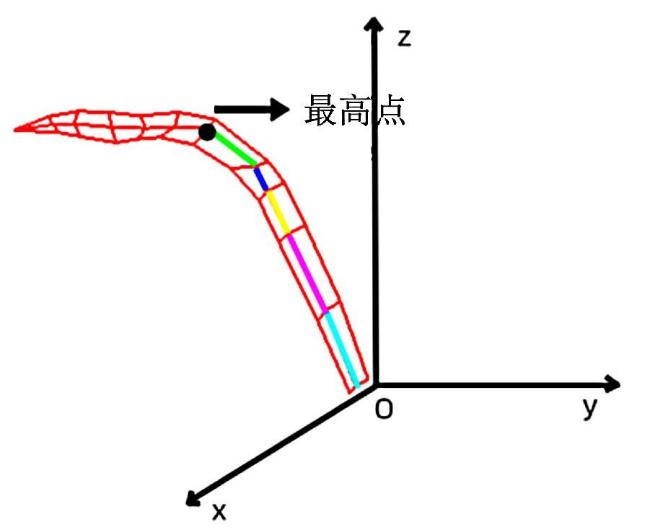
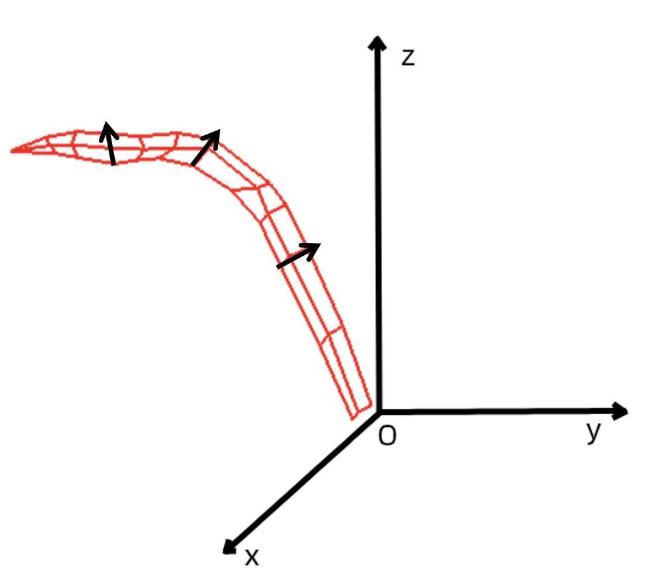
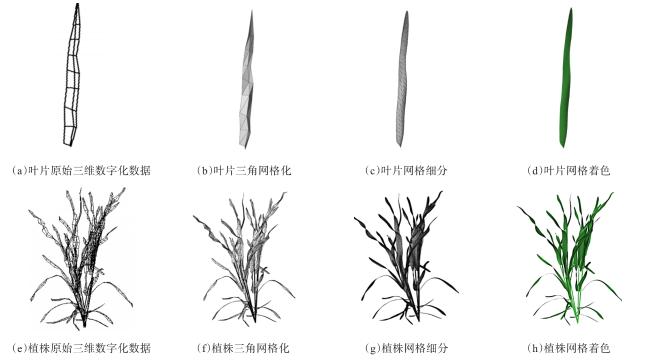
基于图像和基于三维点云的植物株型参数提取是目前应用较多的两类方法,可实现玉米
[12]、棉花
[13]、甜菜
[14]等植物表型参数的提取。但由于小麦属于多分蘖作物,具有分蘖和叶片多、叶片细软的特点,同时叶片相互遮挡严重,基于图像和点云的方法都无法适用于小麦整个生育期,且提取的表型参数有限。目前未见其他方法在不破坏植株原始三维形态结构的情况下,自动批量提取本系统中包含的所有小麦表型参数。在已有的小麦表型参数提取研究中,利用多视角图像系统采集的小麦幼苗图片,结合Mask R-CNN方法
[16]提取了小麦叶长和株高,相关系数
R2 分别为0.87和0.98。本方法提取的小麦叶长和茎长
R2 分别为0.93和0.98,误差更小。基于LiDAR的方法
[17]对2016—2018年连续两年小麦的分蘖数进行了估算,相关系数
R2 分别为0.61和0.56,同时利用高度指标和体积指标构建小麦生物量模型,但缺乏长度和角度等更精准的表型参数的获取。本方法可以直接根据数据集数量得知分蘖数,并提取长度、粗度、角度相关的表型参数。提取的叶长、茎长、茎粗、茎叶夹角的
R2 分别为0.93、0.98、0.93、0.85,叶宽和叶倾角的
R2 分别为0.75、0.73。其中,叶宽和叶倾角的误差相较其他表型参数略大。主要原因是小麦叶片较窄,同时叶片会出现卷曲和扭曲现象,所获取的叶边缘点可能不在叶脉的垂线上,人工测量时也不易确定最大叶宽处。叶倾角误差较大是由于人工测量对测量位置选取不一致导致测量精度不高;而利用三维数字化数据计算的叶倾角是多处提取结果的均值,各种弯曲程度叶片都能实现精度较高的计算结果。